Урок хіміі 9 клас
Кісларод-хімічны элемент і простае рэчыва
Мэта:
- устанавіць асноўныя хімічныя і фізічныя ўласцівасці кіслароду
- растлумачыць сутнасць рэакцыі гарэння;
- стварыць умовы для развіцця даследчых і камунікабельных здольнасцей вучняў.
Эпіграф да ўрока:
“ Разговор и слова нужны, но они только начало, вся суть жизни в делах, в уменье перехода от слова к делу, в их согласовании”
(Д.И. Менделеев)
Тып урока: засваенне новых ведаў
Форма ўрока: урок-практыкум
Матэрыяльна-тэхнічнае абсталяванне: дэманстрацыйны стол, хімічны посуд, часткі прыбораў для атрымання і збірання газаў, шкляная трубка, рэактывы.
Асноўныя тэрміны і паняцці: хімічная рэакцыя, кісларод, аксід, сярністы газ, рэакцыя гарэння
І. Арганізацыйны момант:
- Добры дзень! Наш сенняшні ўрок будзе незвычайны, так як вы самі станеце даследчыкамі ў пошуках новых ведаў.
ІІ. Актуалізацыя ведаў
Выбарачная праверка сшыткаў з дамашнім заданнем.
Рашэнне дамашніх задач каля дошкі.
К І С Л А Р О Д
ІІІ. Паведамленне тэмы і пастаноўка мэты ўрока
- Як вы здагадаліся, на ўроку мы будзем даследаваць фізічныя і хімічныя уласцівасці кіслароду. Запішам тэму ўрока.
Асноўныя пытанні (на дошцы):
1.Фізічныя ўласцівасці.
2.Хімічныя ўласцівасці
3.Рэакцыі гарэння
ІV. Вывучэнне новага матэрыялу
Фізічныя уласцівасці.
Зкладанне табліцы з фізічнымі уласцівасцямі кіслароду:
| Формула | О2 |
| Хімічны знак | О |
| Мr(О2) | 32 |
| Аr(О) | 16 |
| Агрэгатны стан | газападобны, пры t-183ºС – вадкасць |
2.Хімічныя ўласцівасці
Звяртаю ўвагу на тое, што кісларод хімічна актыўнае рэчыва
Дэманстрацыя “Гарэнне серы ў атмасферы кіслароду”
Напішам ураўненне хімічнай рэакцыі
S + O2 → …..
Вучні спрабуюць дапісаць ўраўненне
S + O2 → SO2
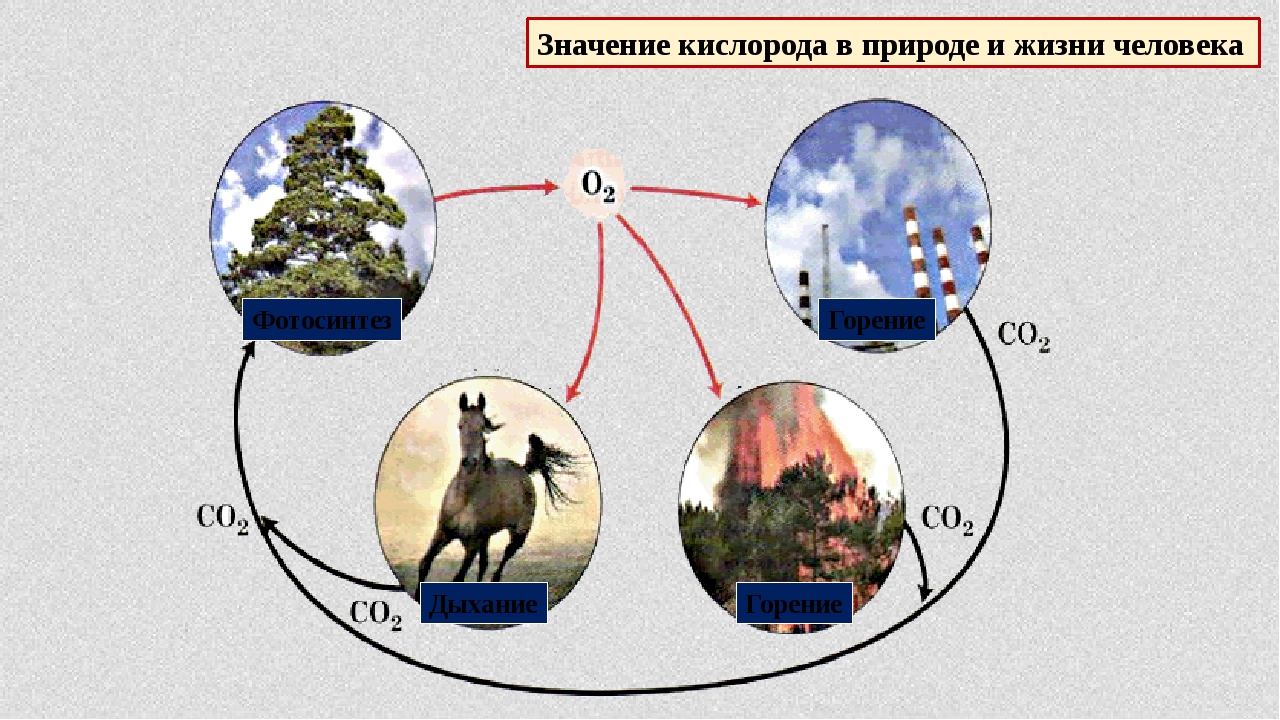
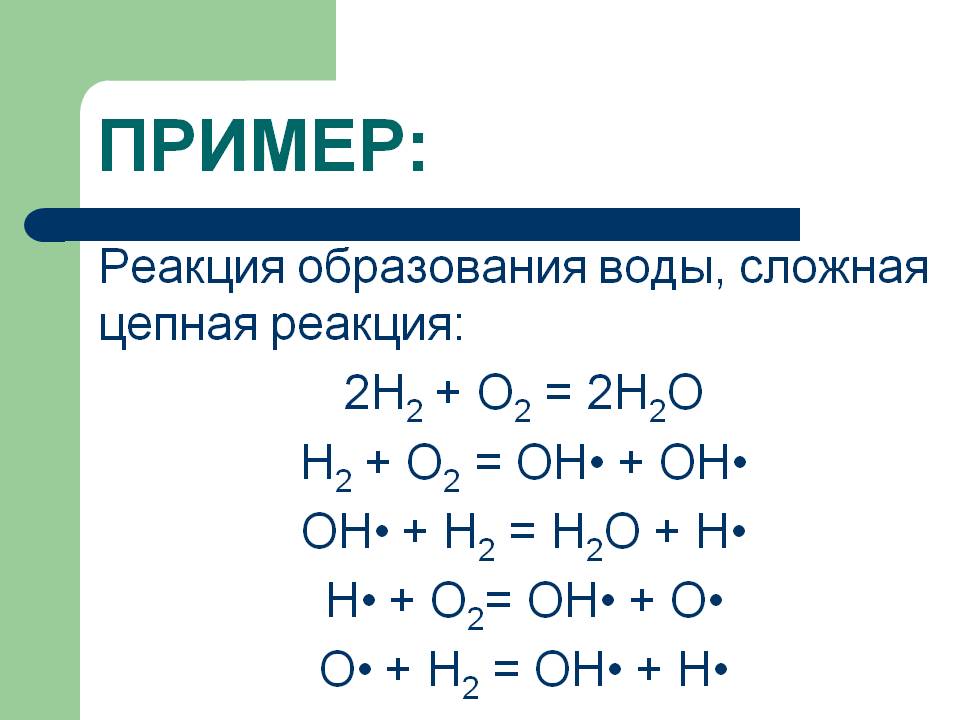
Утварэнне вады
Фізкультхвілінка
| 1 | ХІМІЯ | ХІМІКАЛІЙХІМІЯХІМІЧНЫХІМІЧНАЕХІМІЯХІМІЧНЫЯХІМІЯ | 3 |
| 2 | МАЛЕКУЛА | МАЛЕКУЛЯРНЬШМАЛЕКУЛАМАЛЕНЬКІМАЛЮСЕНЬКІМАЛЕКУЛА | 2 |
| 3 | АТАМ | АТАМАРНЫАТАМАТЫЧНЫАТАМНАЯАЎТОЛІЗАЎТАМАБІЛЬАТАМ | 4 |
| 4 | РЭЧЫВА | РЭЧВАРЭЧАІСНАСНЫРЭЧАВЫРЭЧЫВАРУЧАЁКРЭЧЫВА | 2 |
| 5 | Валентнасць | ВАЛЕНТНАСЦЬВАЛЕНТНЫВЯЛЫБЕЛЫВЕЛАСІПЕДВАЛЕЙБОЛ | 1 |
| 6 | СУМЕСЬ | ЗМЕШАНЫСУМЕСЬСМЕШНЫСМЕЛЫОСУМЕСЬЗМЕШАНЫСУМЕСЬ | 3 |
| 7 | КІСЛАРОД | КІСЛОТНЫКІСЛАРОДКІСЛАТАКІСЛАРОДНЫКІСЛАРОДДКІСЛЫ | 3 |
| 8 | РЭАКЦЫЯ | РЭАКЦЫЯРЭАКЦЫЙНЫРЭАКТЫЎРЭАКЦЫЯРЭАКТТВРЭАКЦЫЯ | 3 |
| 9 | ВАДА | ВОДНЫВАДАВАДАРОДНЫВАДЗЯНЫВАДЗЯНІСТЫВАДАРОД | 3 |
| 10 | КІСЛАТА | КІСЛОТНЫКІСЛАРОДНЫКІСЛАТАКІСЛОТНАСЦЬКІСЛЫКІСЕЛЬ | 1 |
Уважліва прачытайце правую калонку, знайдзіце і падлічыце словы, якія указаны ў левай калонцы. Запішыце ў апошняй калонцы колькасць слоў, якія вы знайшлі ў гэтым радочку. Час выканання – 2 хвіліны
3.Рэакцыі гарэння
Фосфар Магній Жалеза Сера




Гарэнне складаных рэчываў
Метану (звяртаю увагу, што гэта асноўная частка прыроднага газу)
СН4 + О2 → СО2+ Н2О
Расстаўце каэфіцыенты
С3Н8+ О2 → СО2+ Н2О
Расстаўце каэфіцыенты
Вынік:тпры гарэнні складаных рэчываў утвараюцца 2 прадукты рэакцыі – вуглякіслы газ і вада
V.Падвядзенне вынікаў
Вернемся да эпіграфа ўрока. Як вы разумееце словы ДЗ.І. Мендзелеева? Прывядзіце прыклады, якую карысць на практыцы прынясе вам веданне фізічных і хімічных уласцівасцей кіслароду? Якія з’явы ў паўсядзенным жыцці вы можаце прадбачыць?
VІ .Замацаванне матэрыялу.
Вызначыце ступень акіслення кіслароду ўздучэннях: FeO, Fe2O3, H2O2, H2SO3, OF2.
Разлічыце масу кіслароду, неабходнага для поўнага згарання метану CH4 хімічнай колькасцю 5 моль. Які аб'ём (н.у.) вуглякіслага газу пры гэтым утварыцца?
VІІ. Рэфлексія

VІІІ. Дамашняе заданне.
§ 18 Заданні 4,5
























