Конспект урока «Классификация органических соединений. Классификация реакций в органической химии». Повар, кондитер
Цель: сформировать у учащихся общее представление о том, как и зачем классифицируют органические вещества, ввести понятие о классах и функциональных группах. Показать общие принципы номенклатуры ИЮПАК и сформировать умение составлять названия алканов .
Общепринятая классификация органических соединений основана на теории строения А.М. Бутлерова. В любом органическом веществе есть атомы углерода. Соединяясь друг с другом, они образуют прочный «скелет» молекулы. Недостающие до «заветной четверки» валентности атомов углерода обеспечиваются водородными атомами. Такие вещества называются углеводородами.
Углеводород – органическое соединение, состоящее только из атомов углерода и водорода.
По строению углеродной цепи и наличию или отсутствию в ней кратных связей все углеводороды делятся на множество классов.
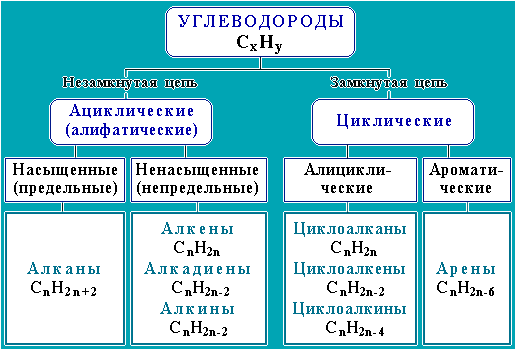
Если углеводород не содержит кратных связей и цепь углеродных атомов не замкнута, он относится к классу алканов.
Наличие в молекуле углеводорода одной двойной связи позволяет отнести его к классу алкенов
Наличие двух двойных связей характерно для алкадиенов.
Углеводороды с тройной углерод-углеродной связью называют алканами.
Арены – класс углеводородов, содержащих шестичленный цикл с особой системой химических связей между атомами углерода. – класс углеводородов, содержащих шестичленный цикл с особой системой химических связей между атомами углерода.
Помимо углерода и водорода в состав органических веществ могут входить атомы других элементов, в первую очередь кислорода и азота. Атомы этих элементов в различных сочетаниях образуют группы, которые называются функциональными.
Функциональная группа – группа атомов, определяющая наиболее характерные химические свойства и его принадлежность определенному классу соединений.
Функциональная группа – ОН называется гидроксильной и определяет принадлежность к одному из важнейших классов органических веществ – спиртам. Название спиртов образуется с помощью суффикса –ол. Атом кислорода может быть связан с атомом углерода двойной химической связью. Группа С=О называется карбонильной.
Карбонильная группа входит в состав нескольких функциональных групп, в том числе альдегидной карбоксильной. Органические вещества, содержащие эти функциональные группы, называются альдегидами и карбоновыми кислотами.
Названия альдегидов и карбоновых кислот образуются следующим образом:
Для альдегидов: алкан + аль
C2H6 + CHO = CH3-CHO
Для карбоновых кислот: алкан + ов+ая+кислота
C2H6 + COOH = CH3-COOH
Аминогруппа – группа, содержащая NH2
C2H6 + NH2 = CH3-CH2- NH2
На заре развития органической химии, когда известных веществ было не так много, ученые придумывали для каждого из них свое собственное название. Как правило, это название было связано с тем объектом живой природы, из которого выделено вещество, либо со способом его получения, либо с наиболее характерным свойством. Эти исторически сложившиеся названия – тривиальные.
Число известных органических соединений увеличивалось очень быстро. Возникла необходимость в создании номенклатуры, которая позволяла бы не придумывать и запоминать, а составлять и конструировать названия органических веществ по их химическому строению. Эта задача была возложена на Международный союз химиков IUPAC, и в середине XX века такая номенклатура была создана. Она называется международной номенклатурой IUPAC.
Эта номенклатура – своеобразное химическое эсперанто, понятное ученым всего мира. Она достаточно проста и лаконична. Для того чтобы ею пользоваться, нужно знать названия первых представителей класса предельных углеводородов (алканов), а также суффиксы, определяющие принадлежность вещества тому или иному классу органических соединений.
Названия органических веществ образуют в соответствии с несколькими правилами.
Основу названия составляет наименование предельного углеводорода с тем же числом атомов углерода, что и в данном соединении.
Наличие кратной связи или функциональной группы в молекуле отражается в названии с помощью определенного суффикса, характерного для данного класса органических соединений.
Положение кратной связи или функциональной группы в цепи обозначают цифрой, соответствующей номеру атома углерода, который связан с функциональной группой или от которого начинается кратная связь. Нумерацию цепи углеродных атомов начинают с того конца, к которому ближе разветвление, кратная связь или функциональная группа.
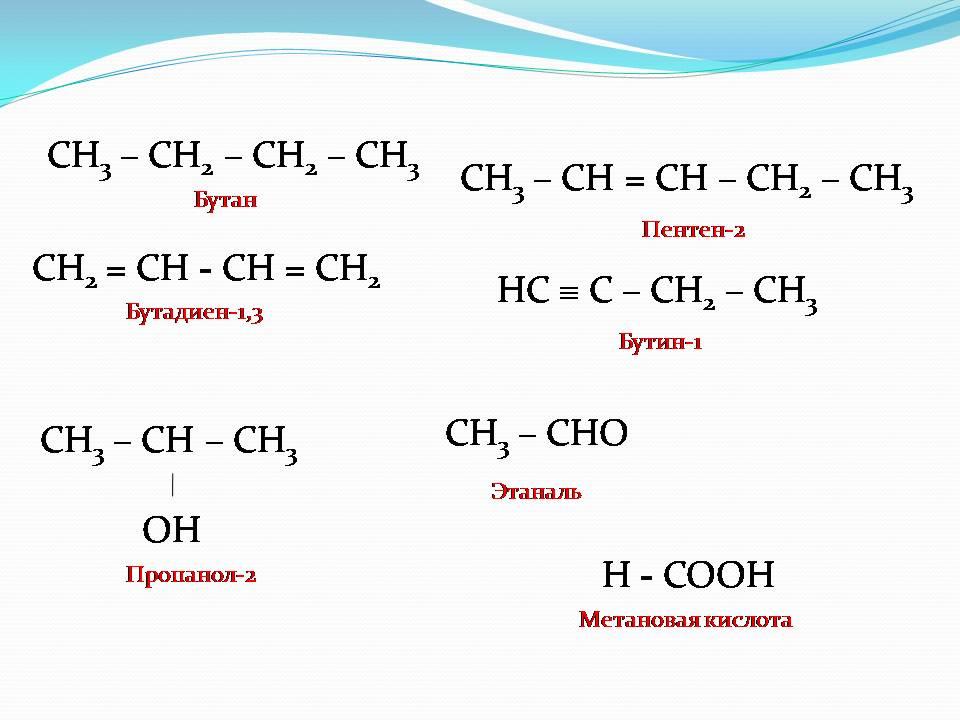
Подведем итог. Здесь приведены названия, отличительные признаки и конкретные представители важнейших классов органических соединений.

Классификация реакций в органической химии
В зависимости от числа исходных веществ и продуктов реакции, а также тех изменений, которые происходят с реагирующими веществами, в неорганической химии различают четыре типа реакций: соединения, разложения, замещения и обмена. Сохраняется ли такая классификация в органической химии? Она похожа, но обладает некоторыми особенностями.
Реакции присоединения.
Как правило, к реакциям присоединения способны органические вещества с кратными связями. В ходе реакции кратность связи уменьшается: двойная связь превращается в простую, тройная – в двойную. За счет освободившихся валентностей два атома углерода присоединяют фрагменты реагента.

Чаще всего в качестве реагентов в реакциях присоединения выступают водород, галогены, галогеноводороды, вода. Этим частым случаям присоединения часто дают собственные названия:
Реакция гидрирования
CH2 = CH2 + H2 CH3 – CH3
этилен этан
Реакция галогенирования
CH2 = CH2 + Cl2 CH2Cl-CH2Cl
этилен 1,2-Дихлорэтан
Реакция гидрогалогенирования
CH2 = CH2 + HBr CH3-CH2Br
этилен бромэтан
Реакция гидратации
CH2 = CH2 + H2O CH3 – CH2 – OH
этилен этиловый спирт
Реакции отщепления.
По своему характеру реакции отщепления обратны реакциям присоединения. В неорганической химии подобные процессы называют разложением. В большинстве реакций отщепления отрыв атомов или групп происходит от соседних атомов углерода исходной молекулы. За счет освободившихся валентностей образуется вторая углерод-углеродная связь. В зависимости от того, какие именно частицы отщепляются от исходного органического вещества, различают реакции дегидрирования, дегалогенирования, дегидрогалогенирования, дегидратации. Все эти названия в точности повторяют названия реакций присоединения, только снабжены «удаляющей» приставкой де-. И по сути это часто взаимно противоположные процессы:
Реакция дегидрирования
CH3 – CH3 CH2 = CH2 + H2
этан этилен
Реакция дегидрогалогенирования
CH3-CH2Br + NaOH CH2 = CH2 + NaBr + H2O
бромэтан этилен
Реакция дегидратации
CH3 – CH2 – OH CH2 = CH2 + H2O
этиловый спирт этилен
Реакция дегидрогалогенирования демонстрирует важную особенность реакций отщепления в органической химии, которая состоит в том, что исходным может быть не одно вещество, как в неорганической химии, а два. При этом второй реагент помогает «отрывать» уходящую молекулу от основного органического вещества.
Реакции замещения.
Пожалуй, это самый распространенный тип реакций в органической химии. При протекании таких реакций в органическом веществе один атом или группа атомов замещаются на другие, например:
CH3Br + NaOH CH3OH + NaBr
бромметан метиловый
спирт
CH4 + Cl2 CH3Cl + HCl
метан хлорметан
В неорганической химии подобные реакции были бы отнесены к реакциям обмена. Специфика превращений в органической химии заключается в том, что отнесение к тому или иному типу реакций проводят с учетом изменений, произошедших в молекуле более сложного из исходных веществ.
Реакции изомеризации.
Вам уже известно, что вещества, имеющие одинаковый состав, но различное химическое строение, называют изомерами. Очевидно, что реакциями изомеризации называют превращение вещества в изомерное ему соединение. В результате такого превращения происходит перераспределением атомов в молекуле, изменяется порядок их связи друг с другом. Например, при нагревании алкана линейного строения в присутствии катализатора он может превращаться в изомерный углеводород с разветвленным углеродным скелетом:
CH3 – CH2 – CH2 – CH3 CH3 – CH – CH3
CH3
бутан изобутан
Следует отметить, что приведенная классификация не охватывает всего многообразия реакций в органической химии.




















