
Коллоидная химия – наука о поверхностных явлениях и дисперсных системах .
Поверхностные явления – совокупность явлений, связанных с физическими особенностями границ раздела между соприкасающимися фазами .
Дисперсные системы – гетерогенные системы, в которых одна из фаз находится в дисперсном (раздробленном состоянии).
Дисперсная система
Дисперсная фаза
(раздробленная часть
дисперсной системы)
Дисперсионная среда
(непрерывная часть дисперсной системы)

Признаки объектов коллоидной химии
1. Гетерогенность (многофазность).
2. Дисперсность (раздробленность).

Меры дисперсности
Поперечный размер частицы (а) – диаметр для сферических частиц ( d ) и длина ребра для кубических частиц ( l ).
Дисперсность ( D ) – величина, обратная поперечному размеру частицы: D =1/ a .
Удельная поверхность ( S уд ) – межфазная поверхность, приходящаяся на единицу объема или массы дисперсной фазы:
Частицы сферической формы
Частицы цилиндрической формы
Частицы кубической формы
2
 10 -5 " width="640"
10 -5 " width="640"
Зависимость удельной поверхности от размера частиц
I – молекулярные системы (истинные растворы)
a -9
II – высокодисперсные, коллоидные (наносистемы)
10 -9 a - 7
III – среднедисперсные (микрогетерогенные)
10 -7 a -5
IV – грубодисперсные
a 10 -5

Пример :
Дисперсность частиц коллоидного золота 10 8 м -1 . Принимая частицы золота в виде кубиков определить, какую поверхность они могут покрыть, если их плотно уложить в один слой. Масса коллоидных частиц золота 1 г. Плотность золота 19,6·10 3 кг/м 3 .
Решение :
1. Общая поверхность частиц коллоидного золота S = S уд · V .
2. Удельная поверхность кубических частиц S уд = 6 D .
3. Объем золота равен V = m /ρ .
Тогда:
4

Особенности коллоидных систем
1. Избыточная поверхностная энергия G S
При увеличении дисперсности увеличивается удельная поверхность частиц дисперсной фазы, большая часть всех молекул или атомов находится на поверхности раздела фаз в несимметричном силовом поле, что приводит к возникновению избыточной поверхностной энергии.
2. Термодинамическая неустойчивость
3 . Невоспроизводимость (индивидуальность)
4. Способность к структурообразованию
5

Виды дисперсных систем
ДФ
ДС
Твердая
Обозначение
Газообразная
Примеры
Т/Г
Жидкая
Жидкая
Твердая
Аэрозоли (пыль, дым, смог )
Т/Ж
Газообразная
Т/Т
Золи (золи металлов в воде, взвеси в природных водах – ВД), суспензии - ГД
Ж/Г
Жидкая
Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы – самоцветы)
Аэрозоли (туман, облака)
Ж/Ж
Газообразная
Твердая
Эмульсии (молоко, сырая нефть, крема)
Газообразная
Ж/Т
Жидкость в пористых телах (адсорбенты, почвы)
Г/Г
Жидкая
Системы с флуктуациями плотности (атмосфера)
Г/Ж
Твердая
Г/Т
Газовые эмульсии, пены
Пористые и капиллярные тела (адсорбенты, катализаторы, пемза, активированный уголь)
6

Получение дисперсных систем
Диспергационные методы
измельчение крупных образцов вещества до частиц дисперсных размеров;
химический состав и агрегатное состояние вещества не меняется;
затрачивается внешняя работа;
используют для получения грубодисперсных систем – производство цемента (1 млрд.т в год), измельчении руд полезных ископаемых, помол муки и т.д.

Для облегчения диспергирования используют понизители твердости (электролиты, эмульсии, ПАВ и др.)
Понизители твердости составляют 0,1 % от общей массы измельчаемых веществ и при этом снижают энергозатраты на получение дисперсных систем более чем в два раза.
8

Конденсационные методы
- основаны на ассоциации молекул в агрегаты из истинных растворов;
- используют для получения высокодисперсных систем;
- не требуют затраты внешней работы;
- появление новой фазы происходит при пересыщении среды.
8

Стадии конденсации
1. Зародышеобразование - возникновение центров кристаллизации в пересыщенном растворе; зародыши образуются тем легче, чем больше чужеродных частиц.
2 . Рост зародышей .
3. Формирование слоя стабилизатора (ДЭС).
8

Физические конденсационные методы
1. Метод конденсации из паров – образование тумана в газовой фазе при понижении температуры.
Образование тумана, облаков, производство H 2 SO 4 , H 3 PO 4 .
2. Метод замены растворителя – раствор вещества приливают к жидкости, в которой это вещество практически не растворимо.
Получение гидрозолей серы, холестерина, канифоли и др.
11

Химические конденсационные методы
Методы основаны на образовании м.р.с. в результате протекания химических реакций .
1. Реакции восстановления (получение золей Au , Ag , Pt ).
Восстановление аурата натрия формальдегидом .
2 NaAuO 2 + 3 HCOH + Na 2 CO 3 = 2 Au + 3 HCOONa + NaHCO 3 + H 2 O
Строение мицеллы :
12

2. Реакции обмена.
Получение золя иодида серебра.
AgNO 3 + KJ (изб.) = AgJ ↓ + KNO 3
Строение мицеллы:
13

3. Реакции окисления
Образование золя серы.
2H 2 S р-р + O 2 = 2S ↓ + 2H 2 O
Строение мицеллы :
14

4. Реакции гидролиза
Получение золя гидроксида железа.
FeCl 3 + 3 H 2 O = Fe ( OH ) 3 ↓ + 3 HCl
C троение мицеллы:
14

Метод пептизации
Пептизация – метод, основанный на переводе в коллоидный раствор осадков, первичные размеры которых уже имеют размеры высокодисперсных систем.
Суть метода: свежевыпавший рыхлый осадок переводят в золь путем обработки пептизаторами (растворами электролитов, ПАВ, растворителем).
14

Методы очистки дисперсных систем
Н изкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы.
Диализ – отделение золей от низкомолекулярных примесей с помощью полупроницаемой мембраны.
Электродиализ – диализ, ускоренный внешним электрическим полем.
Ультрафильтрация – электродиализ под давлением (гемодиализ).
17
 d . Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красный При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца). Светомаскировка - синий свет. Сигнализация – красный, оранжевый свет. Окраска драгоценных камней и самоцветов Рубин – коллоидный раствор Cr или Au в Al 2 O 3 , Сапфир - коллоидный раствор Ti в Al 2 O 3 , Аметист – коллоидный раствор Mn в SiO 2 . 17 " width="640"
d . Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красный При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца). Светомаскировка - синий свет. Сигнализация – красный, оранжевый свет. Окраска драгоценных камней и самоцветов Рубин – коллоидный раствор Cr или Au в Al 2 O 3 , Сапфир - коллоидный раствор Ti в Al 2 O 3 , Аметист – коллоидный раствор Mn в SiO 2 . 17 " width="640"
Особенности коллоидных растворов
- Опалесценция (светорассеяние) наблюдается когда λ d .
Чем короче длина волны падающего света, тем больше рассеяние.
400 нм - синий, 780 нм - красный
При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца).
Светомаскировка - синий свет.
Сигнализация – красный, оранжевый свет.
Окраска драгоценных камней и самоцветов
Рубин – коллоидный раствор Cr или Au в Al 2 O 3 ,
Сапфир - коллоидный раствор Ti в Al 2 O 3 ,
Аметист – коллоидный раствор Mn в SiO 2 .
17

2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического поля.
Причина электрофореза - наличие двойного электрического слоя (ДЭС) на поверхности частиц ДФ.
Электрокинетический потенциал (дзета-потенциал) – потенциал, возникающий на границе скольжения АВ при относительном перемещении фаз в электрическом поле.
17

Строение коллоидных мицелл
Мицелла – частица дисперсной фазы вместе с ДЭС.
Внутренняя часть мицеллы - агрегат , состоящий из большого числа молекул или атомов м.р.с.
Агрегат электронейтрален, но адсорбирует на своей поверхности ионы из раствора – ПОИ.
Правило Фаянса-Пескова :
«На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
- входят в состав агрегата;
- способны достраивать кристаллическую решетку агрегата;
- образуют малорастворимое соединение с ионами агрегата;
- изоморфны с ионами агрегата.»
20

Агрегат вместе с ПОИ составляет ядро мицеллы . Заряженное ядро мицеллы, притягивает ПИ из раствора. Часть ПИ образует адсорбционный слой.
Ядро с ПИ плотной части ДЭС образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда ПОИ.
Коллоидную частицу окружают ПИ диффузной слоя – остальная часть ПИ, подвергающихся броуновскому движению и менее прочно связанная с ядром.
В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
21

Пример 1:
AgNO 3 – электролит-стабилизатор
Ag + – ПОИ, – ПИ
22

Устойчивость и коагуляция дисперсных систем
Устойчивость – неизменность во времени основных параметров дисперсной системы: степени дисперсности и равномерного распределения частиц дисперсной фазы в дисперсионной среде.
Коагуляция – процесс разрушения коллоидных систем за счет слипания частиц, образования более крупных агрегатов с потерей устойчивости и последующим разделением фаз.
23

Коагуляция золей электролитами
Правила электролитной коагуляции
- Все электролиты при определенной концентрации могут вызвать коагуляцию золя.
- Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы.
Этот ион называют ионом-коагулятором.
- Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции (коагулирующей способностью).
24

Порог коагуляции ( γ, С кр ) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя
Коагулирующая способность ( Р ) – величина, обратная порогу коагуляции
- Влияние заряда иона-коагулятора (правило Шульце-Гарди): коагулирующая способность электролита возрастает с увеличением заряда иона – коагулятора
n = 2 ÷ 6
25
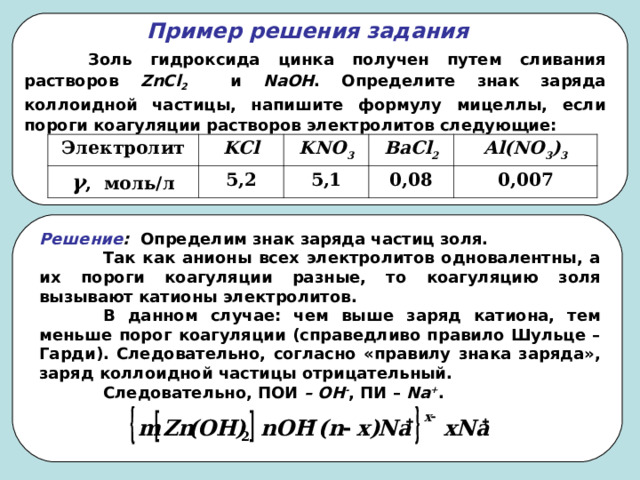
Пример решения задания
Золь гидроксида цинка получен путем сливания растворов ZnCl 2 и NaOH . Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:
Электролит
KCl
γ , моль/л
KNO 3
5,2
BaCl 2
5,1
Al(NO 3 ) 3
0,08
0,007
Решение : Определим знак заряда частиц золя.
Так как анионы всех электролитов одновалентны, а их пороги коагуляции разные, то коагуляцию золя вызывают катионы электролитов.
В данном случае: чем выше заряд катиона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы отрицательный.
Следовательно, ПОИ – ОН - , ПИ – Na + .
25









 10 -5 " width="640"
10 -5 " width="640"














 d . Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красный При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца). Светомаскировка - синий свет. Сигнализация – красный, оранжевый свет. Окраска драгоценных камней и самоцветов Рубин – коллоидный раствор Cr или Au в Al 2 O 3 , Сапфир - коллоидный раствор Ti в Al 2 O 3 , Аметист – коллоидный раствор Mn в SiO 2 . 17 " width="640"
d . Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красный При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца). Светомаскировка - синий свет. Сигнализация – красный, оранжевый свет. Окраска драгоценных камней и самоцветов Рубин – коллоидный раствор Cr или Au в Al 2 O 3 , Сапфир - коллоидный раствор Ti в Al 2 O 3 , Аметист – коллоидный раствор Mn в SiO 2 . 17 " width="640"


















