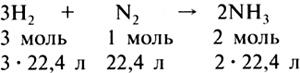Современный урок — это мастерская, где создаются возможности для сознательного усвоения знаний, для развития личности ученика, для формирования ее нравственных основ. По итогам урока судят и о педагогическом мастерстве учителя, и об уровне подготовки ученика.
Просмотр содержимого документа
«Конспект урока: Объемные отношения газов при химических реакциях»
Тема урока: Объемные отношения газов при химических реакциях
Цель урока. Сформировать умение вычислять объемы газов, участвующих в химических реакциях.
Основные понятия. Закон Авогадро, молярный объем.
Планируемые результаты обучения. Уметь вычислять объемы газов, участвующих в химических реакциях.
Краткое содержание урока. В начале урока можно провести самостоятельную работу.
Вариант I
1. Рассчитайте: а) плотность (н. у.) оксида углерода(IV) (г/л); б) относительную плотность оксида азота(IV) по кислороду.
2. Рассчитайте, какой объем (н. у.) займут: а) 0,6 моль азота; б) 10 г водорода; в) 4,5 моль кислорода.
3. Сгорело 6 г углерода. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида углерода(IV) (н. у.).
Вариант II
1. Рассчитайте: а) плотность (н. у.) оксида серы(IV) (г/л); б) относительную плотность сероводорода H2S по водороду.
2. Рассчитайте, какой объем (н. у.) займут: а) 38 г фтора; б) 0,4 моль хлора; в) 1,5 моль кислорода.
3. Сгорело 8 г серы. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида серы(IV) (н. у.).
Переходя к вопросу об объемных отношениях газов при химических реакциях, учитель напоминает учащимся, что коэффициенты, стоящие перед химическими знаками и формулами, показывают не только число молекул или формульных единиц, но и число молей, участвующих в реакции. Поэтому уравнения реакций между газами можно записать и так:
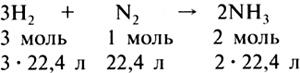
Если разделить указанные численные значения объемов реагирующих и образующихся газов на 22,4, то получатся простые целые числа, показывающие объемные отношения газов: 3 : 1 : 2. Следовательно, реакции между газообразными веществами подчиняются определенным закономерностям: при неизменном давлении объемы реагирующих и образующихся газов относятся между собой как небольшие целые числа.
Коэффициенты в уравнениях реакций показывают число объемов реагирующих и образующихся веществ:
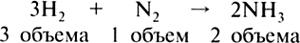
Далее на конкретном примере дается алгоритм решения типовой задачи.
Задача. Вычислите объем углекислого газа (оксида углерода(IV)), который выделится при сгорании 2 л метана (н. у.).

Чтобы закрепить умение решать такие задачи, учащимся можно дать несколько задач для самостоятельного выполнения. Учащиеся могут также придумать свои варианты задач и решить их.
Домашнее задание: §45 задача 1-4 с.156