Самоопределение к деятельности (2 мин.) «Отыщи всему начало, и ты многое поймешь»
Козьма Прутков В ПС Д.И.М. особняком стоят благородные газы. Это уникальные химические элементы, так как даже в форме простого вещества они существуют в виде отдельных атомов, не связанных друг с другом. До сих пор ученые затрудняются ответить на вопрос, как рассматривать их частицы в простом веществе: как свободные атомы, или как одноатомные молекулы? Нет ответа на вопрос о типе кристаллической решетки благородных газов. По физическим свойствам это вещества с молекулярными кристаллами. А по составу?.. Получается, что силы межмолекулярного взаимодействия, удерживающие частицы в кристаллах, действуют между атомами. Почему атомы благородных газов так самодостаточны? В природе же, атомы большинства элементов не существуют разрозненно, а соединяются между собой. Какова причина всего этого? Сегодня мы вспомним, каким образом, по какому механизму происходит соединение атомов химических элементов между собой. | Подготовка к уроку. Приветствие.
Отвечают на вопросы учителя. Причиной объединения большинства атомов является стремление к наиболее устойчивому энергетическому состоянию, которое достигается при завершении внешнего энергетического уровня. Атомы благородных газов имеют завершенный восьмиэлектронный (2-хэлектронный у гелия) внешний энергетический уровень
|
Постановка учебной задачи, актуализация знаний Прочтите отрывок из книги «Занимательно о химии» (Л. Власов, Д. Трифонов) назовите текст, сформулируйте тему урока.
Фронтально: Природа химической связи – электронная. Какое значение имеет электронное строение атомов для определения характера химической связи между взаимодействующими атомами? Определите тип химической связи в соединениях: рутил – TiO2, сера – S8, киноварь - HgS, флюорит – CaF2.
На самом деле в киновари тип химической связи – ковалентная полярная. Почему, попробуем ответить на этот вопрос в конце урока. Для этого выясним: вспомним и дополним наши знания об ионной химической связи. Что представляют собой ионы?
Тенденцию к приему электронов (восстановлению) проявляют атомы неметаллов. Следовательно, можно ожидать, что ионная связь образуется в соединениях металлов с неметаллами. Снова, противоречие: как в случае с AlCl3 или Al2O3? Какая связь в этих соединениях, если известно, что у них атомная кристаллическая решетка и соответствующие свойства: высокие прочность и температура плавления, т.е. ковалентная химическая связь? Какими?
Обобщение и систематизация знаний (25 мин.) Природа ионной химической связи Природу ионной связи, структуру и свойства ионных соединений объясняют с позиций электростатической теории химической связи. По данной схеме объясните механизм образования химической связи в кристалле хлорида натрия: 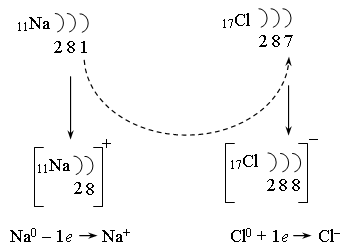
Дем. видеоопыта «Горение металлического натрия в хлоре» Верно, в результате этой ОВР образуются катионы сильно электроположительного элемента и анионы сильно электроотрицательного элемента. Ионная связь осуществляется за счет электростатического притяжения катионов к анионам в результате перехода электрона. Это связь в бинарном соединении. А какие соединения с этим типом связи, но большим количеством элементов вам известны? Каков состав ионов в таких соединениях? Классифицируйте ионы по различным признакам.
У веществ с ионной химической связью энергия связи определяется энергией кристаллической решетки (Е, которую необходимо затратить для разрыва всех химических связей – разъединения всех ионов- в 1 моле в-ва) Е (LiF) = 1004 кДж/моль Е (NaCl) = 755 кДж/моль Чем меньше размеры ионов и чем больше их заряд, тем сильнее у них электростатическое поле и прочнее ХС. По мере увеличения валентных электронов у металлов способность к образованию ионных связей уменьшается - AlCl3. Но в растворе - это соединение с ионной связью. Т.е. существует еще классификация ионов: гидратированные и негидратированные. Важнейшей особенностью ионной связи является: - ненасыщаемость: каждый положительно заряженный катион притягивается ко всем анионам, участвующим в построении кристаллической решетки данного вещества (а не только к тем, которые раположены рядом) и отталкивается от всех положительно заряженных катионов; точно так же к данному аниону может притягиваться любое число катионов. - ненаправленность: как следует из закона Кулона (физического закона, описывающего взаимодействие любых заряженных тел или частиц), притяжение разноименно заряженных ионов, как и отталкивание одноименно заряженных ионов, возможно по любому направлению пространства. Ненасыщаемость и ненаправленность приводит в ионных кристаллах к структурам плотнейших упаковок, важной характеристикой которых является координационное число (КЧ) – число противоионов, окружающих в кристалле данный ион. Дем. кристаллической решетки хлорида натрия (каждый ион натрия окружен шестью ионами хлора и наоборот). Свойства ионных соединений. Вспомните, какими свойствами обладают ионные соединения?
Причина образования ионных соединений Ионная связь – результат взаимодействия самых типичных металлов с самыми типичными неметаллами. Это утверждение относительно: соли аммония, имеющие ионную химическую связь, состоят исключительно из неметаллов. Аналогично и для органических веществ - солей образованных аминами при взаимодействии их с кислотами. Соединений с ионным типом связи химической связи весьма ограниченное количество, но даже в них чисто ионной связи не наблюдается. Так, например, не существуют «чистые» ионы натрия и хлора с зарядами +1 и -1 соответственно. Истинный заряд этих ионов составляет +0,8 и -0,8. Следовательно, даже в соединениях, которые рассматриваются как ионные, в некоторой степени проявляется ковалентный характер связи. Вернемся к вопросам, возникшим в начале урока: почему в киновари тип химической связи – ковалентная полярная; у хлорида и оксида алюминия атомная кристаллическая решетка и соответствующие физические свойства? Дайте краткое, лаконичное определение ионной химической связи с учетом вышесказанного.
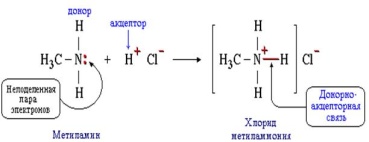
Применение знаний и умений в новой ситуации (10 мин.) Составьте схему образования связи хлорида метиламмония (Дем. видеоопыта «Взаимодействие метиламина с соляной кислотой)
Выпишите формулы соединений с иной связью: PCl3, CO2, AlCl3, Cl2, AlF3, BaO. Составьте схемы их образования, укажите число атомов всех элементов в формульных единицах этих в-в.
В каком соединении более выражен ионный характер химической связи: хлороводород, хлориды калия, лития, натрия? На основании строения атомов лития и фтора и расположения их в Периодической системе элементов дайте аргументированный прогноз относительно возможности образования между ними химической связи. Подведение итогов. Домашнее задание. 6. Рефлексия деятельности. Подведение итогов (2 мин.) -Молодцы. Спасибо за урок. Настало время подвести итоги. Что нового сегодня узнали на уроке? Чему научились? Что понравилось? Выставление оценок |
«Быстрое чтение». Называют текст, например «Механизм образования ионной связи». Формулируют тему урока, определяют цель Записывают тему урока в тетрадь Отвечают на вопросы. Предполагают ионную связь в: TiO2, HgS, CaF2, т.к. связь элементов металлов с неметаллами. S8– ковалентное соединение, образованное элементом неметаллом.
Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов. Соглашаются с утверждением Значит ИХС возникает м/у некоторыми Ме и неМе.
Галогенидами и оксидами щелочных и щелочноземельных металлов. Т.е. между типичными металлами и типичными неметаллами.
Объясняют принцип возникновения данного типа связи
Гидроксиды щелочных, щелочноземельных металлов и соли.
Признаки классификации: а) по составу: простые (натрия и т.п.) сложные (гидроксид-, сульфат- и т.п.) б) по заряду: катионы, анионы
Высказывают основные позиции. Низкая летучесть, отсутствие запаха, сравнительно высокие температуры плавления, кипения. Расплавы таких соединений проводят электрический ток; если соединение с ионной связью растворимо в воде, в растворе оно ведет себя как электролит. Ионные соединения – хрупкие: деформация кристаллической решетки приводит к тому, что одноименные заряды оказываются друг против друга и отталкиваются, решетка разрушается.
Индивидуальная работа с текстом «Ионная связь. Электроотрицательность. Шкала Полинга»
Сравнивают электроотрицательности элементов. Делают вывод о типе химической связи – ковалентная полярная связь. Формулируют, записывают в тетрадь: Ионная связь – крайний случай ковалентной полярой связи, но в отличие от неё связь ненаправленная.
Работа у доски и в тетради
К ионным соединениям относятся: BaO, AlF3 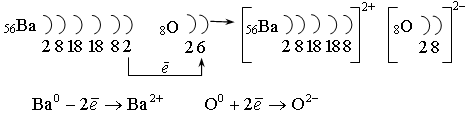
хлорид калия
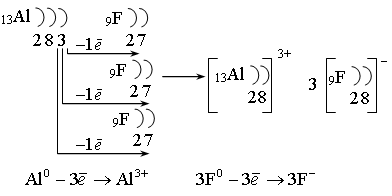
Литий отдает фтору один валентный электрон, превращается в катион, фтор электрон принимает, превращаясь в анион. Разность ЭО составляет 3,03, следовательно, тип химической связи – ионная. п. 4, з. 5, 6, 8 Анализируют свою деятельность. Высказывают свое мнение |




















