План-конспект урока по химии 9 класс
Тема урока: Реакции ионного обмена и условия их протекания.
Цель урока: Закрепить и углубить изучение реакции обмена, заложенные в курсе 8 класса; сформировать понятие необратимых реакций ионного обмена. Выяснить условия протекания реакций ионного обмена в растворах электролитов до конца
Задачи:
образовательные:
- повторить типы химических реакций, признаки их протекания;
- формировать знания о реакциях ионного обмена, протекающих с образованием
конечного продукта;
- знать алгоритм составления полного и сокращенного ионного уравнения.
развивающие:
- развитие навыков работы с химическими реактивами; соблюдая правила безопасной
работы с ними;
- формировать умения составления полного и сокращенного ионного уравнений
основе молекулярного.
воспитательные:
- воспитывать познавательный интерес к предмету;
- повышать мотивацию к урокам химии.
Тип урока: изучение нового материала.
Оборудование: учебник с электронным приложением, реактивы: растворы Na2CO3, HCl, NaOH, NaCl2. AgNO3, фенолфталеин, пробирки.
Ход урока:
I. Организационный момент
II. Актуализация и систематизация знаний
Вспомните:
- Назовите признаки химических реакций? (Ответы учащихся)
- Какие Вы знаете типы химических реакций? (Ответы учащихся)
- К какому типу относятся химические реакции, записанные на доске:
NaOH + H2SO4 =
Ответ:
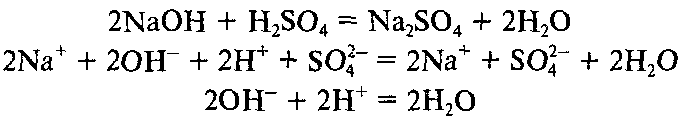
Сформулируйте тему нашего урока (Ответы учащихся)
Проблемный вопрос: Почему кислоты 100 % концентрации не проводят электрический ток, т.е. не являются электролитами?
III. Изучение нового материала:
Фронтальная работа с классом:
А) Из приведенных ниже веществ выбрать электролиты и неэлектролиты, дать названия:
BaCl2; H2SO4; H2; Na2CO3; H2O; Al2O3; Fe(OH)3; CuSO4; SO3.
Б) «Крестики - нолики». Найдите и поясните выигрышный путь, где располагаются НЕэлектролиты.
HCl MgO KOH
CuSO4 Na2S H2SO4
N2 K2O BaSO4
В) Определите лишнее вещество и ее признак:
1. HCl; H2SO4; HNO3; H2S (т.к. слабый электролит)
2. H2O; NaOH (т.к. щелочь сильный электролит ); H2SO3; H2CO3
Лабораторная работа: «Реакции ионного обмена между растворами электролитов»
Беседа с учащимися про реакции ионного обмена и условия их протекания. Для подтверждения выводов конкретными примерами учащиеся выполняют лабораторную работу.
HCl + NaOH = (в присутствии метилового оранжевого)
CuSO4 + NaOH=
Na2CO3 + HCl =
После выполнения исследований учащиеся записывают признак каждой реакции, составляют уравнение реакций в полной и сокращенной ионных формах.
IV. Формирование умений и навыков
Функциональная грамотность Однажды русалка заметила, что ее друзья рыбы перестали с ней играть и уплывают подальше от ее дома. Она не могла понять, в чем дело, ведь они не ссорились... И тогда ее мама рассказала ей, что рыбы уплывают, потому что около их дома почти нет растений, и рыбам не хватает кислорода... Русалка подумала, что можно посадить растения, но они будут расти долго... А из старых мудрых книжек она узнала, что можно насытить воду углекислым газом – повышение концентрации СО2 в воде приводит к значительному ускорению в росте растений. В распоряжении русалки оказались: NaOH, ВaCO3, K2SO4, НCl, Ba(NO3)2. помогите русалке получить углекислый газ.
Проверка задания:
BаСО3 + 2HCl  BaCl2 + H2O + CO2
BaCl2 + H2O + CO2
V. Домашнее задание:
VI. Итог урока
- Какие реакции называются реакциями ионного обмена?
- При каких условиях реакции ионного обмена протекают до конца?
- Что нового Вы узнали на уроке? Чему научились?
VII. Оценка знаний