Открытый урок 10В кл
Тема урока: Сера, ее оксиды и кислоты. Свойства разбавленной и концентрированной
серной кислоты. Сульфаты и их свойства.
Цель урока: Ознакомить с соединениями серы и их свойствами.
Задачи урока:
1. Расширить знания о свойствах соединений серы.
2. Развивать у учащихся мыслительную деятельность.
3. Прививать интерес к предмету.
Тип урока: комбинированный .
Наглядности: периодическая таблица.
Ожидаемый результат: учащиеся должны уметь применять знания на практике.
Ход урока
При входе в класс берут карточки (яблоко, груша, апельсин).
Таким образом разделимся на группы.
I этап. Побуждение.
Учитель: Здравствуйте! У меня сегодня хорошее настроение. А у вас?
Подойдите к магнитной доске и отметьте под смайликом своё настроение. Замечательно. И так мы начинаем наш урок. (слайд 1)
Для дальнейшей работы мы с вами должны выработать критерии ответов от групп.
| Критерии оценки | Правила работы в группах |
| Доступность изложения. Полнота изложения. Аккуратность оформления | 1. Выслушивать всех и каждого 2. Говорить спокойно 3. Выступающие от групп, каждый раз разные 4. Активное участие всех членов группы обязательно |
І. Орг. Момент.
II. Опрос домашнего задания по теме азот и его соединения. Задания группам.
1. Решите цепочку уравнений реакций:
А) N2 → NH3 → NH4NO3→ N2О Б) NH3 → NH4OH → (NH4)2SO4→ NH3→ NH4NO3→ N2О
↓ ↓ ↓ ↓ ↓
NO →NO2 →HNO3→ NаNO3→ NаNO2 N2 NH4Cl NO2 →HNO3
2. Заполните сравнительную таблицу, не заглядывая в шпаргалку:
| Вопросы для сравнения | Аммиак | Азотная кислота |
| Химическая формула |
|
|
| Отношение к воде |
|
|
| Среда водного раствора |
|
|
| Характеристика как электролита |
|
|
| Физические свойства |
|
|
| Химические свойства |
|
|
| Способы получения |
|
|
| Применение |
|
|
3. Пользуясь справочными данными заполните таблицу.
| Название | Оксид азота I | Оксид азота II | Оксид азота III | Оксид азота IV | Оксид азота V |
| формула |
|
|
|
|
|
| Агрегатное состояние |
|
|
|
|
|
| Цвет |
|
|
|
|
|
| Токсичность для организма |
|
|
|
|
|
| Отношение к воде |
|
|
|
|
|
| Кислотно-основные свойства |
|
|
|
|
|
| Особые свойства |
|
|
|
|
|
| Получение |
|
|
|
|
|
| Химические свойства |
|
|
|
|
|
| Применение |
|
|
|
|
|
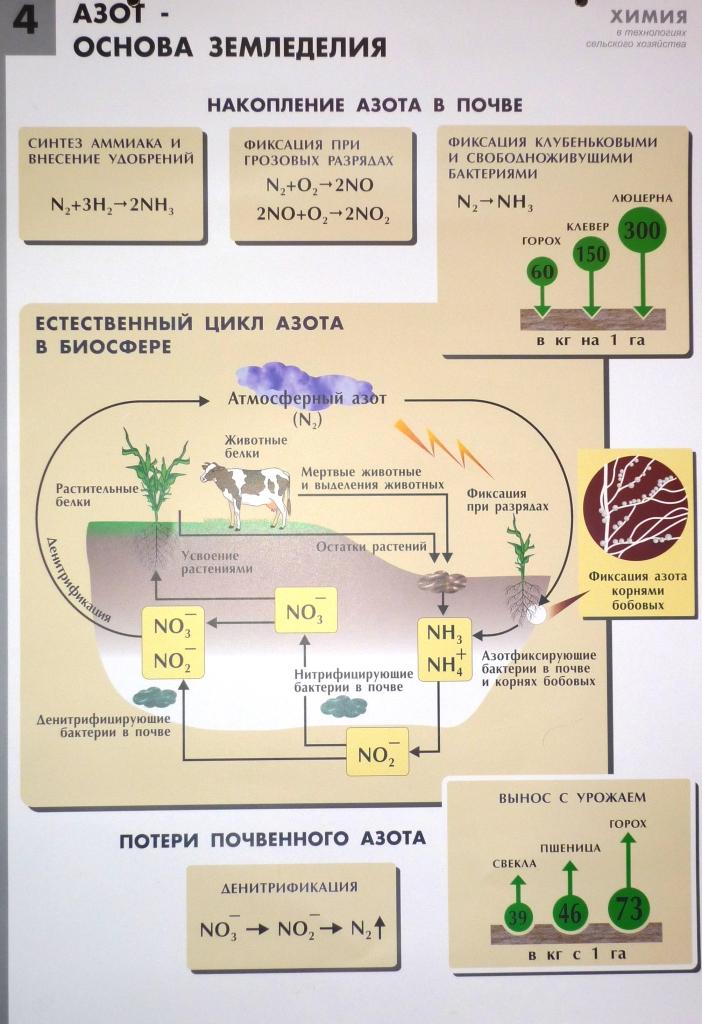
4. Пользуясь картинкой опишите и расскажите о круговороте азота в природе
III. Повторение §2.1-2.3 «Эрудит»
Задача 1. Для гидросульфата натрия постройте графическую формулу и укажите виды химической связи в молекуле: ионная, ковалентная, полярная, ковалентная неполярная, координационная, металлическая, водородная. Объясните, что такое ионная связь? Приведите примеры ее влияния на свойства вещества.
Задача 2. Постройте графическую формулу нитрита аммония и укажите виды химической связи в этой молекуле. Покажите, какие (какая) связи «рвутся» при диссоциации. Объясните, что такое водородная связь? Приведите примеры ее влияния на свойства вещества.
Задача 3. Укажите виды химической связи в следующих молекулах: CH3Br, СаО, J2, NH4Cl. Каковы основные свойства данных видов связи?
Задача 4. Какая связь называется s- и какая — p-связью? Какая из них менее прочная? Изобразите структурные формулы молекулы азота, кислорода и водорода. Отметьте s- и p-связи на структурных схемах веществ.
IV. Изложение нового материала.
Материал для самостоятельного изучения учащихся.
Элементы VIA группы — это кислород, сера, селен, теллур и радиоактивный металл полоний. Первые четыре имеют неметаллический характер и объединяются под общим названием халькогены, что означает “образующие руды”. Атомы элементов VIA группы содержат по шесть электронов на внешнем уровне: два на s-орбиталях и четыре на р-орбиталях: s2p4. Они могут проявлять валентность не только 2, но и 4 и 6.
Строение атома. Сера — элемент VIA группы. Ее электронная формула: 16S ls22s22р6 3s23p4
Распространение в природе. Сера является весьма распространенным элементом. Из соединений серы наиболее распространены сульфиды и сульфаты.
Физические свойства. Сера — твердое кристаллическое вещество желтого цвета. Она существует в трех аллотропных модификациях: ромбическая, моноклинная и пластическая сера. Наиболее устойчивой является ромбическая сера. В парообразном состоянии молекулы серы могут состоять из молекул S2, S4, S8, Smb зависимости от температуры. В воде сера не растворяется, плохо растворяется она в спирте и эфире, хорошо — в сероуглероде (CS2), бензоле и др.
Химические свойства. Сера в обычных условиях малоактивна, однако при повышении температуры ее активность растет. При высокой температуре сера непосредственно соединяется с водородом, образуя сероводород H2S. При поджигании на воздухе или в кислороде сера горит голубоватым пламенем, образуя газообразное вещество оксид серы (IV). Сера может образовывать сульфиды почти со всеми металлами, кроме золота, иридия и палладия. Сера непосредственно взаимодействует также с медью, алюминием, железом, цинком. Сера реагирует с оксидами, кислотами и солями, проявляющими сильное окислительное действие.
S + 2Н2 SO4 = 3SO2 ↑ + 2Н20
S + 2HN03= H2S04 + 2NO↑+ 3S + 2KC103 = 3S02 ↑+ 2KC1
3S + 6КОН = K2S03 + 2K2S + 3Н2О
Получение. Серу можно получить как из источников самородной серы, так и из ее соединений. В промышленности серу получают выплавкой самородной серы перегретым паром через скважины (метод Фраша). Расплавленная сера выносится на поверхность, где ее разливают в формы. В лаборатории серу можно получить окислением сероводорода или сульфидов металлов.
СОЕДИНЕНИЯ СЕРЫ.
Сероводород — бесцветный ядовитый газ с запахом тухлых яиц. Раствор сероводорода в воде представляет собой слабую сероводородную кислоту. Для сероводорода характерны восстановительные свойства. Сульфиды в водных растворах сильно гидро- лизованы. Все сульфиды также являются восстановителями.
Оксид серы (IV). Физические и химические свойства. Оксид серы (IV), или сернистый газ, S02 представляет собой бесцветный газ с резким удушливым запахом. При -10°С он переходит в жидкое состояние, а при -73°С затвердевает. В 1 л воды при комнатной температуре (20°С) растворяется около 40 объемов сернистого газа. Растворение частично сопровождается образованием сернистой кислоты. Он может проявлять свойства окислителя и восстановителя. В присутствии катализатора (Pt, V205) окисляется до серного ангидрида кислородом воздуха: 2S02 + 02→2S03
Сернистый газ обладает всеми свойствами кислотных оксидов: S02+ 2NaOH = Na2S03 + Н20
Оксид серы (VI), или серный ангидрид, S03 при обычных условиях представляет собой бесцветную жидкость, кипящую при 44,6°С, при 16,8°С она застывает в металлическую прозрачную массу. При нагревании выше 50°С кристаллы S03, не плавясь, возгоняются. Крайне гигроскопичен. Серный ангидрид весьма энергично, с выделением большого количества теплоты, взаимодействует с водой, образуя серную кислоту.
Серная кислота. Физические свойства. Серная кислота — бесцветная, малолетучая, маслянистая жидкость плотностью 1,84 г/мл. Ее иногда называют “купоросным маслом” (в старину получали прокаливанием железного купороса FeS04 *7H20). Она очень гигроскопична. Серная кислота хорошо растворяется в воде. Растворение сопровождается выделением большого количества теплоты. При попадании воды на поверхность кислоты она тут же превращается в пар, поэтому для смешивания серной кислоты с водой нужно обязательно вливать кислоту в воду небольшими порциями и перемешивать, а не наоборот! В противном случае первые порции воды могут закипеть и разбрызгать капли раствора серной кислоты, вызвав сильные ожоги.
Концентрированная серная кислота — сильное водоотнимающее средство. Поэтому ее часто используют как поглотитель в эксикаторах. Однако серная кислота поглощает не только свободную воду. Она отнимает ее у других соединений. Если в серную кислоту опустить лучинку или поместить кусочек сахара, то они через некоторое время обугливаются. Это объясняется тем, что серная кислота отнимает у древесины воду, оставляя углерод.
Химические свойства. Серная кислота является сильной и наиболее стойкой из известных минеральных кислот. Она может вытеснить из соли любую кислоту, на чем основаны лабораторные способы получения различных кислот — азотной, хлороводородной (соляной), фтороводородной (плавиковой):
CaF2 + H2S04 = CaS04 + 2HF ↑
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует с основными оксидами, основаниями и солями, в ней растворяются металлы, расположенные в ряду напряжений левее водорода. При растворении металлов в разбавленной серной кислоте образуются сульфаты металлов и выделяется водород. При растворении железа, олова и других металлов, проявляющих несколько степеней окисления, образуются сульфаты металлов с низшей степенью окисления. Например:
Fe + H2S04 = FeS04 + Н2↑
Концентрированная серная кислота обладает сильными окислительными свойствами, она окисляет некоторые металлы, расположенные в ряду напряжений после водорода (например, медь, серебро, ртуть), и многие неметаллы (например, углерод, серу, фосфор). При этом выделяется не водород, а продукты восстановления серы (VI): S02, S или H2S. Степень окисления этих продуктов зависит как от концентрации серной кислоты, так и от активности восстановителя.
Серная кислота является одной из наиболее сильных кислот. Она обладает сильными окислительными свойствами. Объем производства серной кислоты свидетельствует об уровне развития химической промышленности любого государства. Соли серной кислоты — сульфаты — также находят широкое применение в технике и промышленности.
Задания группам.
Составьте кластер, отражающий ваши знания. Строение атома, свойства и способы получения серы.
Составьте схему отражающую свойства и способы получения сероводородной кислоты и ее солей.
Составьте схему отражающую свойства и способы получения кислородных соединений серы.
Составьте кластер, отражающий ваши знания. Строение молекулы, свойства и способы получения серной кислоты и ее солей.
Закрепление материала.
Первичное закрепление.
| 1 группа | 2 группа | 3 группа |
| Допишите уравнения реакций |
| H2+S----- | S + O2----- | SO2 + O2---- |
| S + Al ----- | K2O ++ SO2---- | Na+ S ---- |
| Составьте уравнения реакций по следующей схеме: |
| SO2---- SO3---- Na2SO4 | S---- SO2----H2SO4 | SO3----H2SO4---CaSO4 |
Вторичное закрепление.
Задание- Предложите свою идею использования серы в производстве.
Напишите мини-сочинение (3-5 предложений)
Подведение итогов урока (заполните третью колонку , что вы узнали на сегодняшнем уроке)
Рефлексия.
Что сегодня вам показалось самым интересным?
Что удивило вас?
Что понравилось в нашей работе и что не понравилось?
Д/з §7.10-7.12; повт. §2.4-2.6

















