8 класс. Контрольная работа № 3 по теме
«Типы химических реакций. Расчеты по химическим уравнениям»
1 вариант
Задание 1
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид фосфора (V)+ вода → фосфорная кислота
б) соляная кислота + магний → хлорид магния + водород
в) хлорид бария + сульфат железа (III) → сульфат бария + хлорид железа (III)
г) гидроксид меди (II) �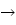 � оксид меди (II) + вода
� оксид меди (II) + вода
Задание 2. Рассчитайте количество вещества и массу кислорода, необходимого для получения 10 моль оксида углерода (IV) по схеме:
С + O2 = CO2
Задание 3. Рассчитайте объем водорода (н.у.), полученного при взаимодействии алюминия, массой 270 г с соляной кислотой?
Задание 4.Запишите уравнения реакций. Назовите вещества.
а) S→ SO2 → H2SO3
б) Li →L2O →LiOH
8 класс. Контрольная работа № 3 по теме
«Типы химических реакций. Расчеты по химическим уравнениям»
2 вариант
| 1) CaO + SiO2 = CaSiO3 | 4) Fe2O3 + 2Al = Al2O3 + 2Fe |
| 2) FeS + 2HCl = FeCl2 + H2S | 5) LiСl + AgNO3 = LiNO3 + AgCl |
| 3) 2KClO3 = 2KCl + 3O2 | 6) 2Ca + O2 = 2CaO |
1. Расставьте коэффициенты в уравнениях химических реакций, укажите их тип.
2.Какая масса фосфора необходима для получения 71 г оксида фосфора (V)?
3.Кальций массой 2 г прореагировал с кислородом. Какой объем кислорода вступил в реакцию?
4. Запишите уравнения реакций. Назовите вещества.
а) S→ SO2 → H2SO3
б) Na→ Na 2O → Na OH
8 класс. Контрольная работа № 3 по теме
«Типы химических реакций. Расчеты по химическим уравнениям»
3 вариант
1.Расставьте коэффициенты в уравнениях химических реакций, укажите их тип.
| 1) BaO + H2O = Ba(OH)2 | 4) Ca(OH)2 + 2HCl = CaCl2+2H2O |
| 2) CuO + H2 = Cu + H2O | 5) 2NH3 = N2 + 3H2 |
| 3) 3KOH + H3PO4 = K3PO4 + 3H2O | 6) Mg + 2HCl = MgCl2 + H2 |
2.Сколько граммов ртути можно получить при разложении 43,4 г оксида ртути (II)?
3.При прокаливании 7 кг известняка (карбоната кальция) СаСОз образуется оксид кальция и углекислый газ. Какой объем оксида углерода при этом получится
4. Запишите уравнения реакций. Назовите вещества.
а) P→ P2O5→ H3PO4
б) K→ K 2O → K OH
8 класс. Контрольная работа № 3 по теме
«Типы химических реакций. Расчеты по химическим уравнениям»
4 вариант
1.Расставьте коэффициенты в уравнениях химических реакций, укажите их тип.
| 1) BaO + H2O = Ba(OH)2 | 4) Ca(OH)2 + 2HCl = CaCl2+2H2O |
| 2) CuO + H2 = Cu + H2O | 5) 2NH3= N2 + 3H2 |
| 3) N2 + O2 = 2NO | 6) Mg + 2HCl = MgCl2 + H2 |
2.Какой объем кислорода необходим для сгорания 18 г углерода. Если образовался оксид углерода (1V)
3.Сколько граммов серы необходимо для получения 128 г оксида серы (IV)?
4. Запишите уравнения реакций. Назовите вещества.
а) P→ P2O5→ H3PO4
б) K→ K 2O → K OH
8 класс. Контрольная работа № 3 по теме
«Типы химических реакций. Расчеты по химическим уравнениям»
5 вариант
1.Расставьте коэффициенты в уравнениях химических реакций, укажите их тип.
| 1) CaO + H2O = Ca(OH)2 | 4) Mg(OH)2 + 2HCl = MgCl2+2H2O |
| 2) CuO + H2 = Cu + H2O | 5) 2NH3= N2 + 3H2 |
| 3) N2 + O2 = 2NO | 6) Ba + 2HCl = BaCl2 + H2 |
2.По уравнению реакции Cu(OH)2 = CuO + H2O найдите массу оксида меди (II), образовавшегося при разложении 39,2 г гидроксида меди (II).
3.По уравнению реакции Zn(OH)2 = Zn O + H2O определите массу оксида цинка, который образуется при разложении 198 г исходного вещества.
4. Запишите уравнения реакций. Назовите вещества.
а) S→ SO2 → H2SO3
б) Na→ Na 2O → Na OH
8 класс. Контрольная работа № 3 по теме
«Типы химических реакций. Расчеты по химическим уравнениям»
6 вариант
1.Расставьте коэффициенты в уравнениях химических реакций, укажите их тип.
| 1) CaO + SiO2 = CaSiO3 | 4) Fe2O3 + 2Al = Al2O3 + 2Fe |
| 2) FeS + 2HCl = FeCl2 + H2S | 5) NaСl + AgNO3 = NaNO3 + AgCl |
| 3) 2KNO3 = 2KNO2 + O2 | 6) 2Al(OH)3 = Al2O3 + 3H2O |
2.По уравнению реакции Fe(OH)2 = FeO + H2O определите массу оксида железа (II), образовавшегося при разложении 45 г исходного вещества.
3.По уравнению реакции CaО + H2OCa (OH)2 определите массу гидроксида кальция, образовавшегося при взаимодействии 112 г оксида кальция с водой.
4. Запишите уравнения реакций. Назовите вещества.
а) P→ P2O5→ H3PO4
б) K→ K 2O → K OH















