Конспект открытого урока по физике ( 10 класс)
Тема урока-обобщения
«Кристаллические и аморфные тела»
Цели урока:
обучающая-
сформировать понятия: «кристаллическое тело»,
«кристаллическая решетка», «монокристалл»,
«поликристалл», «аморфное тело»;
выявить основные свойства кристаллических и
аморфных тел;
развивающая-
развивать умения выделять главное;
развивать умение систематизировать материал;
развивать познавательный интерес к предмету,
используя разнообразные формы работы;
воспитательная -
воспитывать научное мировоззрение.
План урока:
I. Организационный момент
II. Проверка ранее изученного материала
III Актуализация и мотивация знаний (обобщение)
IV.Закрепление
V. Подведение итогов. Домашнее задание.
. I.Организационный момент
В окружающем нас мире с веществами происходят различные физические и химические процессы. И, несмотря на многообразие веществ, они могут находиться только в трёх агрегатных состояниях. Сегодня на уроке вы познакомитесь с кристаллическими и аморфными телами и их свойствам.
II. Проверка ранее изученного материала.
Основные положения МКТ.
Ответить на вопросы:
Вопросы:
1.Какие наблюдения показывают,что каждое тело состоит из мельчайших частиц?
2.Какие факты доказывают,что между молекулами существуют промежутки ?
3 Какие факты доказывают, что между молекулами твердых тел существуют силы притяжения?
4.Какие факты доказывают, что между молекулами жидкости существуют силы притяжения?
5 Какие факты доказывают, что между молекулами газов существуют силы притяжения?
6 Какие факты доказывают, что между молекулами веществ есть силы отталкивания?
III Актуализация и мотивация знаний (обобщение)
Учитель: Вещества, которые находятся на ваших столах, имеют разное внутреннее строение, но агрегатное состояние их одинаковое. Какое?
Правильно: все эти вещества твердые.
Все ли твердые тела одинаковы? Чем объясняется такое разнообразие? Мы рассмотрим это на нашем уроке.
С древних времен кристаллы привлекали человека своей красотой. Их цвет, блеск и форма затрагивали человеческое чувство прекрасного, и люди украшали ими себя и жилище. С давних пор с кристаллами были связаны суеверия; как амулеты, они должны были не только ограждать своих владельцев от злых духов, но и наделять их сверхъестественными способностями. Украшения из кристаллов сейчас столь же популярны, как и раньше. Когда те же самые минералы стали разрезать и полировать, как драгоценные камни, многие суеверия сохранились в талисманах «на счастье» и «своих камнях», соответствующих месяцу рождения.
 Кристаллы - это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.
Кристаллы - это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.
Все драгоценные природные камни, кроме опала, являются кристаллическими, и многие из них, такие, как алмаз, рубин, сапфир и изумруд, попадаются в виде прекрасно ограненных кристаллов.
Для наглядного представления строения кристаллов используются кристаллические решетки. В узлах решётки располагаются центры атомов или молекул данного вещества. Атомы в кристаллах плотно упакованы, расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решёток указывается только положение центров атомов.
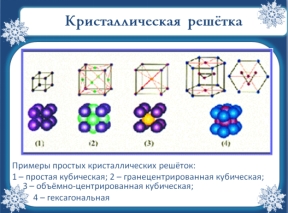 В каждой кристаллической решетке можно выделить элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса элементарной ячейки по некоторым направлениям. Примеры простых кристаллических решёток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка. Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
В каждой кристаллической решетке можно выделить элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса элементарной ячейки по некоторым направлениям. Примеры простых кристаллических решёток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка. Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
Известный русский кристаллограф Евграф Степанович Фёдоров установил, что в природе может существовать только 230 различных пространственных групп, охватывающих все возможные кристаллические структуры. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллы могут иметь форму различных призм, основанием которых могут быть правильный треугольник, квадрат, параллелограмм и шестиугольник. Поэтому кристаллы имеют плоские грани. Например, крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы. Это можно заметить, рассматривая соль с помощью лупы.
 Идеальные формы кристаллов симметричны. По выражению Евграфа Степановича Фёдорова, кристаллы блещут симметрией. В кристаллах можно найти различные элементы симметрии: плоскость симметрии, ось симметрии, центр симметрии. Кристалл в форме куба (NaCl , KCl и др.) имеет девять плоскостей симметрии, тринадцать осей симметрии, кроме того, он имеет центр симметрии. Всего в кубе 23 элемента симметрии.
Идеальные формы кристаллов симметричны. По выражению Евграфа Степановича Фёдорова, кристаллы блещут симметрией. В кристаллах можно найти различные элементы симметрии: плоскость симметрии, ось симметрии, центр симметрии. Кристалл в форме куба (NaCl , KCl и др.) имеет девять плоскостей симметрии, тринадцать осей симметрии, кроме того, он имеет центр симметрии. Всего в кубе 23 элемента симметрии.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное свойство кристаллов анизотропия - это зависимость физических свойств от выбранного в кристалле направления.
 У кристаллов по разным направлениям обнаруживается различная механическая прочность. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее.
У кристаллов по разным направлениям обнаруживается различная механическая прочность. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее.
Легко расслаивается в одном направлении кристалл графита. Слои образованы рядом параллельных сеток, состоящих из атомов углерода. Атомы располагаются в вершинах правильных шестиугольников. Расстояние между слоями сравнительно велико - примерно в 2 раза больше, чем длина стороны шестиугольника, поэтому связи между слоями менее прочны, чем связи внутри них.
От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Многие кристаллы по-разному проводят тепло и электрический ток в различных направлениях.
Металлы имеют кристаллическую структуру. Но если взять сравнительно большой кусок металла, то его кристаллическое строение никак не проявляется, ни во внешнем виде, ни в его физических свойствах. Почему металлы в обычном состоянии не обнаруживают анизотропии?
 Оказывается, металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Под микроскопом или даже с помощью лупы их нетрудно рассмотреть, особенно на свежем изломе металла. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению друг к другу беспорядочно. В результате все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Оказывается, металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Под микроскопом или даже с помощью лупы их нетрудно рассмотреть, особенно на свежем изломе металла. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению друг к другу беспорядочно. В результате все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Одиночные кристаллы - монокристаллы имеют правильную геометрическую форму, и их свойства различны по разным направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллом. Большинство кристаллических тел - поликристаллы, так как они состоят из множества сросшихся кристаллов.
Просмотр видео «Познавательное о кристаллах»
Учитель: Свойства кристаллических тел:
Атом занимают определённые, упорядоченные положения в пространстве.
Кристаллы имеют свою температуру плавления.
Анизотропия – зависимость физических свойств от направления внутри кристалла.
Кристаллы делятся на моно- и поликристаллы.
Монокристаллы - одиночные кристаллы (кварц, алмаз,графит, слюда, крупинки соли и сахара).
Поликристаллы - состоят из большого числа маленьких кристалликов (металлы, сахар, поваренная соль).
Мы живем на поверхности твердого тела – земного шара, в сооружениях, построенных из твердых тел. Орудия труда, машины также сделаны из твердых тел. Но не все твёрдые тела – кристаллы. Кроме кристаллических тел существуют - аморфные тела. Примером аморфных тел являются смола, стекло, канифоль, сахарный леденец и др.
Часто одно и то же вещество может находиться как в кристаллическом, так и в аморфном состоянии. Например, кварц SiO2 может быть как в кристаллической, так и в аморфной форме (кремнезем). У аморфных тел нет строгого порядка в расположении атомов. Только ближайшие атомы-соседи располагаются в некотором порядке По расположению атомов и по их поведению аморфные тела аналогичны жидкостям.
Кристаллическую форму кварца схематически можно представить в виде решетки из правильных шестиугольников. Аморфная структура кварца также имеет вид решетки, но неправильной формы. Наряду с шестиугольниками в ней встречаются пяти- и семиугольники. Аморфные тела – это твёрдые тела, где сохраняется только ближний порядок в расположении атомов.
Все аморфные тела изотропны, т. е. их физические свойства одинаковы по всем направлениям. При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства, подобно твердым телам, и текучесть, подобно жидкости. Так, при кратковременных воздействиях (ударах) они ведут себя как твердые тела и при сильном ударе раскалываются на куски. Но при очень продолжительном воздействии аморфные тела текут. В этом вы можете убедиться сами, если запасетесь терпением. Проследите за куском смолы, который лежит на твердой поверхности. Постепенно смола по ней растекается, и, чем выше температура смолы, тем быстрее это происходит.
С течением времени некристаллическое вещество может «переродиться», или, точнее, закристаллизоваться, частицы в них собираются в правильные ряды. Только срок для разных веществ различен: для сахара это несколько месяцев, а для камня — миллионы лет. Пусть леденец полежит спокойно месяца два-три. Он покроется рыхлой корочкой. Посмотрите на нее в лупу: это мелкие кристаллики сахара. В некристаллическом сахаре начался рост кристаллов. Подождите еще несколько месяцев — и уже не только корочка, но и весь леденец закристаллизуется. Даже наше обыкновенное оконное стекло может закристаллизоваться. Очень старое стекло становится иногда совершенно мутным, потому, что в нем образуется масса мелких непрозрачных кристаллов.
Аморфные тела при низких температурах по своим свойствам напоминают твердые тела. Текучестью они почти не обладают, но по мере повышения температуры постепенно размягчаются и их свойства все более и более приближаются к свойствам жидкостей. Это происходит потому, что с ростом температуры постепенно учащаются перескоки атомов из одного положения равновесия в другое. Определенной температуры плавления у аморфных тел, в отличие от кристаллических, нет. Они не имеют постоянной температуры плавления и обладают текучестью. Аморфные тела изотропны, при низких температурах они ведут себя подобно кристаллическим телам, а при высокой подобны жидкостям.
Свойства аморфных тел:
Свойство №1: нет строгого порядка в расположении атомов.
Свойство №2: аморфные тела не имеют постоянной температуры плавления (они не
плавятся, а размягчаются.)
Свойство №3: Все аморфные тела изотропны – их физические свойства одинаковы по
всем направлениям. В телах, находящихся в аморфном состоянии, нельзя обнаружить
даже очень малые области, внутри которых наблюдалась бы зависимость физических
свойств от направления. Тепловые, электрические и оптические свойства аморфных тел
оказываются совершенно не зависящими от направления.
V. Подведение итогов урока.
VI. Домашнее задание: п. 72 стр. 238- 242






 Кристаллы - это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.
Кристаллы - это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.  В каждой кристаллической решетке можно выделить элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса элементарной ячейки по некоторым направлениям. Примеры простых кристаллических решёток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка. Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
В каждой кристаллической решетке можно выделить элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса элементарной ячейки по некоторым направлениям. Примеры простых кристаллических решёток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка. Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).  Идеальные формы кристаллов симметричны. По выражению Евграфа Степановича Фёдорова, кристаллы блещут симметрией. В кристаллах можно найти различные элементы симметрии: плоскость симметрии, ось симметрии, центр симметрии. Кристалл в форме куба (NaCl , KCl и др.) имеет девять плоскостей симметрии, тринадцать осей симметрии, кроме того, он имеет центр симметрии. Всего в кубе 23 элемента симметрии.
Идеальные формы кристаллов симметричны. По выражению Евграфа Степановича Фёдорова, кристаллы блещут симметрией. В кристаллах можно найти различные элементы симметрии: плоскость симметрии, ось симметрии, центр симметрии. Кристалл в форме куба (NaCl , KCl и др.) имеет девять плоскостей симметрии, тринадцать осей симметрии, кроме того, он имеет центр симметрии. Всего в кубе 23 элемента симметрии.  У кристаллов по разным направлениям обнаруживается различная механическая прочность. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее.
У кристаллов по разным направлениям обнаруживается различная механическая прочность. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее.  Оказывается, металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Под микроскопом или даже с помощью лупы их нетрудно рассмотреть, особенно на свежем изломе металла. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению друг к другу беспорядочно. В результате все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Оказывается, металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Под микроскопом или даже с помощью лупы их нетрудно рассмотреть, особенно на свежем изломе металла. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению друг к другу беспорядочно. В результате все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.









