
Квантовые постулаты Бора. Модель атома водорода по Бору
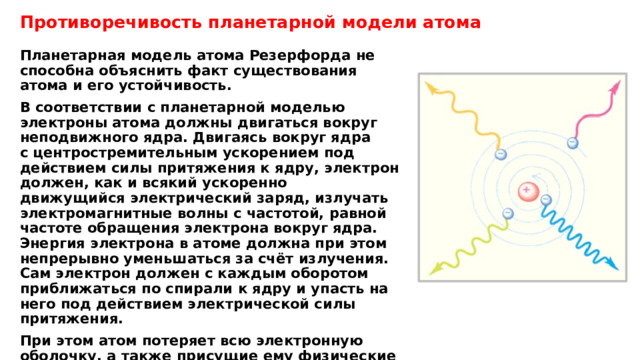
Противоречивость планетарной модели атома
Планетарная модель атома Резерфорда не способна объяснить факт существования атома и его устойчивость.
В соответствии с планетарной моделью электроны атома должны двигаться вокруг неподвижного ядра. Двигаясь вокруг ядра с центростремительным ускорением под действием силы притяжения к ядру, электрон должен, как и всякий ускоренно движущийся электрический заряд, излучать электромагнитные волны с частотой, равной частоте обращения электрона вокруг ядра. Энергия электрона в атоме должна при этом непрерывно уменьшаться за счёт излучения. Сам электрон должен с каждым оборотом приближаться по спирали к ядру и упасть на него под действием электрической силы притяжения.
При этом атом потеряет всю электронную оболочку, а также присущие ему физические и химические свойства.
Кроме того, атом должен потерять спектр излучения частот, то есть атом должен давать излучение с непрерывным (сплошным) спектром частот.

Противоречивость планетарной модели атома
Эти результаты, полученные с помощью классической механики и электродинамики, находятся в резком противоречии с опытом, который показывает, что
- атомы являются весьма устойчивыми системами и в невозбуждённом состоянии могут существовать неограниченно долго, не излучая при этом электромагнитные волны
- спектр излучения атома является линейчатым (дискретным) – образованным из отдельных линий.
Всё это свидетельствует о том, что законы классический физики применить к электронам в атомах нельзя, поэтому необходимы новые представления о механизме излучения и поглощения атомами электромагнитных волн.
В основе современной теории атома лежит квантовая механика – теория, устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем, а также связь величин, которые характеризуют частицы и системы, с физическими величинами, измеряемыми опытным путём.

Квантовые постулаты Бора
В 1913 году датский физик Нильс Бор ввёл идеи квантовой теории в ядерную модель атома Резерфорда и разработал теорию атома водорода, которая подтвердилась всеми известными тогда опытами.
В основе теории Бора лежат два постулата. Квантовые постулаты Бора – это два основных допущения, введённые Н. Бором для объяснения устойчивости атома и спектральных закономерностей (в рамках модели атома Резерфорда ).
Нильс Хенрик Давид Бор,
датский физик (7.10.1885—18.11.1962)

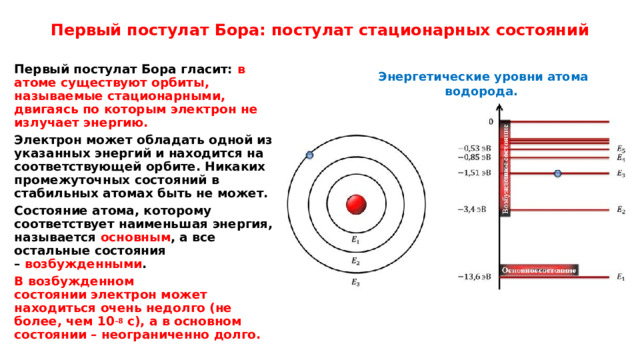
Первый постулат Бора: постулат стационарных состояний
Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия E n . В стационарном состоянии атом не излучает.
= - - энергия атома водорода в n – м
стационарном состоянии.
1 = 2,18 – внесистемная единица энергии, называемая ридбергом (в честь шведского физика И.Р. Ридберга)
n - целое число, определяющее номер квантового состояния и энергию атома в этом состоянии, называется главным квантовым числом .
Обратите внимание, что в атомной физике энергия измеряется в эВ (электрон-вольтах).
1 эВ = 1,6 Дж
Значения разрешённого набора ,... называются уровнями энергии атома. В целом, набор энергий условно бесконечен (уровни энергий сходятся)
Энергетические уровни атома водорода
На рисунке представлена диаграмма энергетических уровней атома водорода. По вертикальной оси отложены энергии состояний . В целом, набор энергий условно бесконечен (уровни энергий сходятся)
Первый постулат Бора: постулат стационарных состояний
Первый постулат Бора гласит: в атоме существуют орбиты, называемые стационарными, двигаясь по которым электрон не излучает энергию.
Электрон может обладать одной из указанных энергий и находится на соответствующей орбите. Никаких промежуточных состояний в стабильных атомах быть не может.
Состояние атома, которому соответствует наименьшая энергия, называется основным , а все остальные состояния – возбужденными .
В возбужденном состоянии электрон может находиться очень недолго (не более, чем 10 –8 с), а в основном состоянии – неограниченно долго.
Энергетические уровни атома водорода.
соответствуют атому водорода.
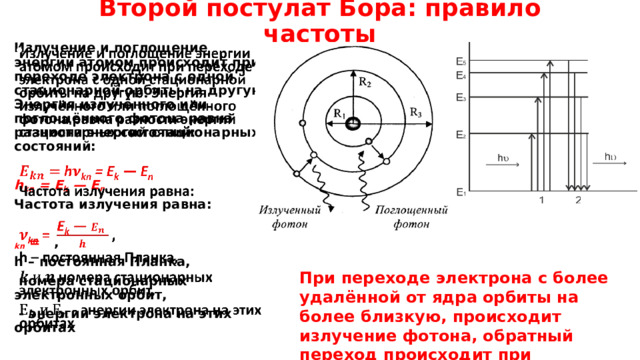
Второй постулат Бора: правило частоты
Излучение и поглощение энергии атомом происходит при переходе электрона с одной стационарной орбиты на другую. Энергия излучённого или поглощённого фотона равна разности энергий стационарных состояний:
h kn = E k — E n
Частота излучения равна:
kn = ,
h – постоянная Планка,
номера стационарных электронных орбит,
- энергии электрона на этих орбитах
При переходе электрона с более удалённой от ядра орбиты на более близкую, происходит излучение фотона, обратный переход происходит при поглощении фотона.
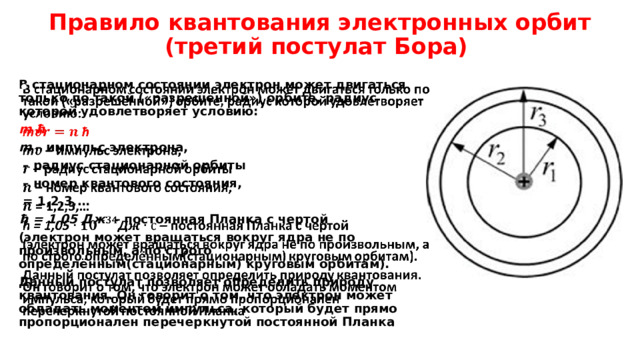
Правило квантования электронных орбит (третий постулат Бора)
В стационарном состоянии электрон может двигаться только по такой («разрешённой») орбите, радиус которой удовлетворяет условию:
m ħ
m – импульс электрона,
– радиус стационарной орбиты
– номер квантового состояния,
= 1,2,3,…
ħ = 1,05 Дж – постоянная Планка с чертой
(электрон может вращаться вокруг ядра не по произвольным, а по строго определённым(стационарным) круговым орбитам).
Данный постулат позволяет определить природу квантования. Он говорит о том, что электрон может обладать моментом импульса, который будет прямо пропорционален перечеркнутой постоянной Планка

Теория атома водорода по Бору
В атоме водорода вокруг ядра с зарядом = e обращается один электрон с зарядом = - e.
На этот электрон действует кулоновская сила F = k = k , сообщая электрону
центростремительное ускорение a = .
По второму закону Ньютона: m = k
Из третьего постулата Бора скорость, с которой электрон движется по орбите равна =
После преобразований получим: r = - радиус стационарной орбиты электрона r.
В основном состоянии, когда n = 1, атом водорода имеет минимальные размеры: = 0,53м.
При переходе атома в возбуждённые состояния(n = 2,3,…) его радиус увеличивается по закону r = , причём, никаких принципиальных ограничений на это увеличение нет.
В 1964 г. радиоастрономами было зафиксировано излучение атомов водорода, находящихся в состояниях с n = 90 и 91. Позже в глубоком космосе были обнаружены атомы водорода с n но наиболее интересным было открытие атомов углерода в состояниях с n =732 и 733. Диаметры этих «гигантских» атомов углерода достигают 0,05мм!

Скорость движения электрона
Скорость электрона на орбите =
Подставим в эту формулу выражение для радиуса орбиты r = .
Получим: = k - скорость электрона на орбите убывает с увеличением числа n.
Максимальную скорость электрон имеет на первой боровской орбите (n=1)
= k =
Но даже и здесь она приблизительно в 137 раз меньше скорости света.
Этим и оправдывается то, что в основу теории атома было положено классическое, а не релятивистское уравнение движения.

Энергия атома водорода
= - - энергия атома водорода в n – м стационарном состоянии
1 = 2,18Дж = 13,6эВ
= - 13,6 эВ – энергия в основном состоянии
= - 3,4 эВ
= - 1,51 эВ
= - 0,85 эВ
= - 0,53 эВ
………………… ..
При переходе в возбужденные состояния энергия атома возрастает.

Энергия связи атома
Энергия связи атома(энергия ионизации) – минимальная энергия, которую нужно затратить для удаления электрона с первой боровской орбиты на «бесконечность»
- энергия связи атома(энергия ионизации)
Если электрону, находящемуся на первой боровской орбите и обладающему, следовательно энергией , сообщить энергию , достаточную для его удаления на «бесконечность»(т.е. на такое расстояние от ядра, где его взаимодействием с ядром можно пренебречь и где энергия электрона равна нулю), то по закону сохранения энергии + = 0, откуда
= - = 13,6 эВ
Если электрону будет передаваться энергия , то при = - атом перейдёт в состояние энергией
При - , то поглощения энергии не произойдёт и атом останется в прежнем состоянии.
Такой «скачкообразный» характер поглощения энергии должен наблюдаться для атомов любого химического элемента. Опыты Д. Франка и Г. Герца в 1913г. подтвердили существование в атомах дискретных энергетических уровней, что сыграло важнейшую роль в развитии квантовой теории атома.

Спектр излучения атома водорода
Свои постулаты Нильс Бор применил для объяснения излучения и поглощения света атомом водорода.
Согласно второму постулату Бора, излучение света происходит при переходе атома с верхних на нижние энергетические уровни. Излучаемые при этом фотоны будут обладать частотами , определяемые формулой = (
= - = - - значения энергии атома в начальном и конечном состояниях.
= (
R = = 109,7- постоянная Ридберга, с – скорость света.
= cR( – всевозможные частоты, определяемые этим выражением и дают спектр излучения атома водорода. Теория Бора приводит к правильным результатам не только в случае атома водорода, но и в случае водородоподобных ионов, т.е. таких ионов, в которых вокруг ядра обращается только один электрон.

Спектр излучения атома водорода
Если атом водорода переходит из более высоких энергетических состояний в третье, излучение света происходит в инфракрасном диапазоне частот
Серия Пашена (инфракрасное излучение)

Спектр излучения атома водорода
Если атом водорода переходит из более высоких энергетических состояний во второе, излучение света происходит в видимом диапазоне
Серия Бальмера (видимый свет)
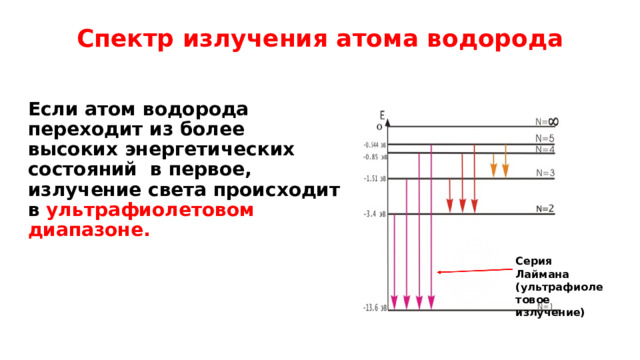
Спектр излучения атома водорода
Если атом водорода переходит из более высоких энергетических состояний в первое, излучение света происходит в ультрафиолетовом диапазоне.
Серия Лаймана (ультрафиолетовое излучение)

Излучение света атомами
На основании теории Бора оказалось возможным построить количественную теорию спектра водорода.
Серии излучения атомов водорода

Достоинства теории Бора
• Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы. Для микромира характерно квантование — дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка с чертой, которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
• Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
• В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Недостатки теории Бора
Теория Бора не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
• Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы — второй закон Ньютона и закон Кулона — используются для записи уравнения движения электрона по круговой орбите.
• Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Не могло быть и речи о распространении теории Бора на более сложные атомы.
• Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая - полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой, построенной десятилетием позже — в 1920-х годах.
Но правила квантования широко используются и в наши дни как приближённые соотношения: их точность часто бывает очень высокой.

Ссылки на изображения
Диаграмма для водородоподобного атома - https://i0.wp.com/www.abitur.by/wp-content/uploads/2017/08/%D0%94%D0%B8%D0%B0%D0%B3%D1%80%D0%B0%D0%BC%D0%BC%D0%B0-%D0%B4%D0%BB%D1%8F-%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BE%D0%BF%D0%BE%D0%B4%D0%BE%D0%B1%D0%BD%D0%BE%D0%B3%D0%BE-%D0%B0%D1%82%D0%BE%D0%BC%D0%B0.png?resize=300%2C269&ssl=1
Нильс Хенрик Давид Бор, фотография - https :// warweapons.ru/wp-content/uploads/2013/02/wpid-0xmvYjPh-b8.jpg
Серии излучения атомов водорода - https:// cf3.ppt-online.org/files3/slide/b/bqR34huzjoQcDL26SkKOE7JW1H0IB5XAT8ntZP/slide-236.jpg
Энергетические уровни атома водорода - https:// rozli.ru/wp-content/uploads/2019/11/667b042e981013a200345961f3edaa97.jpg
Излучение и поглощение энергии атомом - https:// s1.slide-share.ru/s_slide/afb1ebdd3d7d4808e5b6bf4f6095379e/609561c1-82f2-4521-a96b-b4dfd1bc379c.jpeg
Серия Бальмера для водорода - https:// s0.slide-share.ru/s_slide/e8db39b1a0511b418299adcb782f8ebc/047f729a-07fa-4b83-9d1e-d11dd3b1622a.jpeg
Неустойчивость классического атома - https:// physics.ru/courses/op25part2/content/chapter6/section/paragraph2/images/6-2-1.gif



































