Органические и неорганические кислоты
Цели: обобщить, закрепить знания о классификации, номенклатуре, физических и химических свойствах кислот: органических и неорганических кислот; научить объяснять общность химических свойств неорганических и органических кислот и правильно составлять уравнения реакций в молекулярном и ионном виде.
Основные понятия: кислородсодержащие и бескислородные кислоты, основность кислот, летучая и нелетучая кислота, сильная и слабая кислота, стабильная и нестабильная кислота, электрохимический ряд напряжений металлов.
Ход занятия
I. Организационный момент
II. Изучение нового материала
План
1. Определение, классификация, номенклатура, химическая связь, тип кристаллической решетки.
2. Протеолитическая и электронная теории кислотно-основных свойств соединений.
3. Общие химические свойства неорганических и органических кислот в свете теории электролитической диссоциации.
а) действие на индикаторы
б) взаимодействие с металлами, оксидами металлов, основаниями растворимыми и нерастворимыми, солями.
Кислоты — это сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металла и кислотного остатка. Общая формула: НnAс.
Кислоты бескислородные:
HCl — соляная кислота,
H2S — сероводородная кислота.
Кислоты кислородсодержащие:
H2SO4 — серная кислота;
Н3РO4 — ортофосфорная (фосфорная) кислота;
H2SO3 — сернистая кислота;
HNO2 — азотистая кислота;
СН3СООН — уксусная кислота, этановая кислота;
НСООН — метановая кислота (муравьиная кислота):
С17Н35СООН — стеариновая кислота.
Пример: (H2SO4 — серная кислоты, кислородсодержащая, двухосновная, растворимая, нелетучая, сильная, стабильная.
HCl — соляная кислота, бескислородная, одноосновная, растворимая, сильная, летучая, стабильная.
H2S — сероводородная кислота, бескислородная, двухосновная, растворимая, слабая, летучая, стабильная.
H2SO3 — сернистая кислота, кислородсодержащая, двухосновная, растворимая, нестабильная, нелетучая, слабая.
СН3СООН — этановая (уксусная) кислота, кислородсодержащая, одноосновная, растворимая, летучая, слабая, стабильная.
HNO2 — азотистая кислота, кислородсодержащая, одноосновная, растворимая, слабая, нелетучая, стабильная.
НСООН — метановая (муравьиная) кислота, кислородсодержащая, одноосновная, растворимая, летучая, слабая, стабильная.
С17Н35СООН — стеариновая кислота, кислородсодержащая, нерастворимая, нелетучая, слабая, стабильная.)
Кислоты — это электролиты, в водных растворах которых в качестве катиона присутствует катион водорода:

В 1923 г. была предложена протеолитическая теория Бернстедом-Лаури, которая расширила представления о кислотах и основаниях. Эта теория объясняла поведение веществ в водных и неводных растворах.
Согласно этой теории кислоты — это молекулы или ионы, которые являются в данной реакции донорами (дающие) катионов водорода Н+:

Кислота — донор катиона водорода. Катион водорода называется протоном, поэтому теория называется протеолитической.
Согласно электронной теории кислот и оснований американского химика Г. Н. Льюиса один из соединяющихся атомов отдает на образование химической связи свою свободную электронную пару, а другой атом предоставляет свою свободную электронную ячейку (орбиталь). Первый атом — донор электронов, второй атом — акцептор (принимающий) — идет образование химической связи по донорно-акцепторному механизму.
В соответствии с этим Г.Н. Льюис сформулировал новое представление о кислотах и основаниях. Кислоты — те реагенты, которые являются акцепторами электронов. Основания — те реагенты, которые выступают донорами электронных пар.
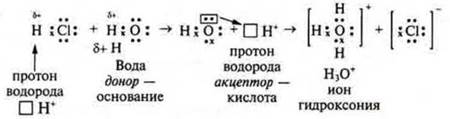
Н3O+ — ион гидроксония. Присутствует в растворах всех кислот, но и он может выступать в роли кислоты — отдавать протон и превращаться в молекулу воды. В уравнениях реакций для простоты записи будем пользоваться обозначением иона гидроксония — Н+.
Общие химические свойства кислот органических и неорганических: кислый вкус, изменение цвета индикаторов, взаимодействие с металлами, оксидами основными и амфотерными, основаниями растворимыми и нерастворимыми, солями, обусловлены катионами водорода в растворах.
Изменение цвета индикаторов:
а) метилоранж — розовый цвет;
б) фенолфталеин — без изменений;
в) синий лакмус — красный цвет;
г) универсальный индикатор — от желтого до розового цвета.
Химические свойства кислот
1.Взаимодействия с металлами, расположенными в электрохимическом ряду напряжений металлов до водорода.
 - неорганическая кислота
- неорганическая кислота

 - органическая кислота
- органическая кислота

2.Взаимодействие с основными и амфотерными оксидами
 - неорганическая кислота
- неорганическая кислота

 — органическая кислота
— органическая кислота

3.Взаимодействие с растворимыми и нерастворимыми основаниями
Многоосновные кислоты могут образовывать кислые соли и средние соли. Это реакции нейтрализации.
Растворимое основание:
 — кислота неорганическая
— кислота неорганическая
 — кислота неорганическая
— кислота неорганическая

 - органическая кислота
- органическая кислота
Нерастворимое основание
 — кислота неорганическая
— кислота неорганическая

 — органическая кислота
— органическая кислота

4.Взаимодействие с солями
Следует помнить, что сильная кислота способна вытеснить слабую кислоту даже из нерастворимой соли.
 — неорганическая кислота
— неорганическая кислота
 — образуются газ, вода
— образуются газ, вода

 — органическая кислота
— органическая кислота
Обобщение общих химических свойств неорганических и органических кислот следует записать в виде схемы.

Специфические свойства неорганических и органических кислот
- Специфические свойства H2SО4(к) и HNО3(к), (р).
- Специфические свойства некоторых органических кислот.
Отдельные представители неорганических кислот обладают сильными окислительными свойствами к металлам, неметаллам, сложным соединениям.
Это вызвано тем, что в серной кислоте H2SО4 сера находится в максимальной С.О., в азотной кислоте HNO3 азот находится в максимальной С.О. +5.
По электрохимическому ряду напряжений металлов разделим все металлы на три группы: от Li до Al — очень активные металлы, от Аl до Н2 — металлы средней активности, от Н2 до Au — малоактивные металлы.

Неметалл окисляется до оксида или кислоты.
При взаимодействии с H2SO4(k) образуются оксиды окисляемых неметаллов, а если окисляется фосфор — то кислота фосфорная, сера восстанавливается до оксида серы (IV).
С HNO3(k) азот всегда восстанавливается до оксида азота (IV), а неметаллы до оксидов или кислот.
С HNO3(p) азот восстанавливается до оксида азота (II), а неметаллы до оксидов или кислот.
Пример: Сu — малоактивный металл.

Окисление неметаллов:


Окисление сложных веществ:

Неорганические кислоты взаимодействуют с органическими веществами: реакции нитрования, сульфирования; нитрование — взаимодействие органических веществе азотной кислотой. Пример: нитрование бензола, нитрование целлюлозы. При нитровании целлюлозы образуются ди- и тринитроцеллюлозы — сложные эфиры, очень необходимые вещества для производства бездымного пороха.
Специфические свойства органических кислот
1.Взаимодействие со спиртами с образованием сложных эфиров.

2.Органические кислоты вступают в реакции замещения по радикалу.

Введение в радикал молекулы кислоты атома галогена увеличивает степень диссоциации в 100 раз.
Cl — самый электроотрицательный элемент в соединении и смешает электронную плотность от углерода в свою сторону, вследствие чего уменьшается электронная плотность у атома углерода, он приобретает еще больший δ+, чем в уксусной кислоте. Атом кислорода в группе —ОН с большей силой свою электронную плотность смешает в сторону углерода № 2, делая тем самым очень подвижным атом водорода.

Некоторые органические кислоты обладают двойственным свойствами.
 — метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.
— метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.

 - молочная кислота, также обладает двойственными свойствами — это спиртокислота.
- молочная кислота, также обладает двойственными свойствами — это спиртокислота.
Некоторые кислоты проявляют восстановительные свойства.

Выводы:
Неорганические и органические кислоты обладают специфическими свойствами. В зависимости отсоединений, с которыми они взаимодействуют, и условий течения реакций они могут проявлять окислительно-восстановительные свойства. Многие кислоты, особенно органические, могут обладать не только свойствами нескольких классов органических веществ, но и проявлять окислительно-восстановительные свойства.
Пример:
 — восстановитель, взаимодействуя с Ag2O(NH3 · Н2O);
— восстановитель, взаимодействуя с Ag2O(NH3 · Н2O);
 — окислитель, взаимодействуя с металлами.
— окислитель, взаимодействуя с металлами.



















 — метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.
— метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.
 - молочная кислота, также обладает двойственными свойствами — это спиртокислота.
- молочная кислота, также обладает двойственными свойствами — это спиртокислота.
 — восстановитель, взаимодействуя с Ag2O(NH3 · Н2O);
— восстановитель, взаимодействуя с Ag2O(NH3 · Н2O); — окислитель, взаимодействуя с металлами.
— окислитель, взаимодействуя с металлами.









