Теория электролитической диссоциации.
Свойства растворов электролитов
Цели: углубить и обобщить знания, основные понятия электролитической диссоциации; научить применять их в составлении уравнений диссоциации, реакций ионного обмена; дать представление об универсальности теории электролитической диссоциации, применении ее для неорганической и органической химии.
Основные понятия: электролиты, неэлектролиты, диссоциация, ассоциация, гидратированные ионы, катионы, анионы, сильные, слабые электролиты, степень электролитической диссоциации, константа диссоциации.
Оборудование: распечатанные вопросы теста на столе, опорный конспект, лекция.
Ход занятия:
I. Организационный момент
II. Изучение нового материала
План
1. Основные понятия теории электролитической диссоциации:
а) электролит и неэлектролит;
б) сильные и слабые электролиты;
в) степень диссоциации, константа диссоциации.
2. Диссоциация кислот, солей, оснований.
3. Реакции ионного обмена.
В 9 классе тема ТЭД была изучена. На данном занятии нам предстоит вспомнить узловые теоретические вопросы данной темы, закрепить основные понятия ТЭД, а также умение составлять уравнения диссоциации электролитов и реакции ионного обмена.
Электролиты — вещества, растворы и расплавы которых проводят электрический ток. Как правило, это соединения с ионной связью и с ковалентной полярной связью:
KCl — ионная связь;
HNO3- — между Н+ и NO3 — ионная связь.
Неэлектролиты — вещества, растворы и расплавы которых не проводят электрический ток (органические соединения, газы):
С6Н12O6 — глюкоза,
С2Н5ОН — этанол, спирт.
Диссоциация — распад электролита на ионы при растворении или расплавлении. Это процесс обратимый. Процесс, обратный диссоциации, называется ассоциацией.
Механизм диссоциации:
а) веществ с ионной связью:
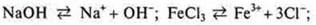
б) веществ с ковалентной полярной связью:
«диполь воды»  поляризует связь, она становится ионной:
поляризует связь, она становится ионной:

Катионы:
Na+ — катион натрия;
Са2+ — катион кальция;
NH4+ — катион аммония.
Анионы:
МnО4- — перманганат-анион;
РO43- — фосфат-анион;
NO2- — нитрит-анион;
HCO3- — гидрокарбонат-анион.
Электролитическая диссоциация Кислот, Солей, Щелочей.
Кислоты — электролиты, в растворах которых представлены в качестве катионов только катионы водорода:
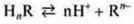
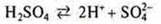
Щелочи — электролиты, в растворах которых представлен в качестве анионов. Только гидроксид-анионы:
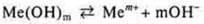
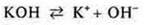
Соли — электролиты, в растворах которых при диссоциации образуются катионы металлов (или ион аммония) и анионы кислотных остатков.
9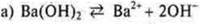
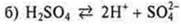 . — основание
. — основание
—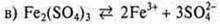 кислота
кислота
—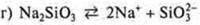 соль средняя
соль средняя
— соль средняя
С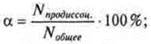 тепень электролитической диссоциации α- показывает процент молекул, продиссоциированных к общему количеству молекул электролита:
тепень электролитической диссоциации α- показывает процент молекул, продиссоциированных к общему количеству молекул электролита:
а) электролиты сильные, α → 1.
HNO3;
Na2S;
КОН.
В их растворах равновесие полностью смещается в сторону прямой реакции:
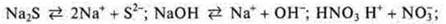
б) электролиты слабые, α → 0.
ВаСO3;
Fe(OH)3;
Са3(РO4)2;
Н3РO4;
NH4OH;
Н2СO3.
Многие диссоциируют ступенчато.
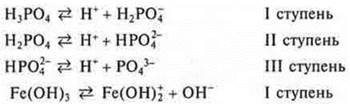
В растворах слабых электролитов равновесие смещается в сторону образования молекул, т. е. в сторону обратной реакции.
Для характеристики слабых электролитов используют константу диссоциации по каждой ступени

Константа диссоциации есть отношение произведения равновесных концентраций катионов и анионов, возведенных в степени коэффициентов равновесных концентраций, к концентрации непродиссоциированных молекул, Kд зависит от природы электролита, природы растворителя, температуры, но не зависит от концентрации.
Иногда Kд вычисляют, используя концентрацию и степень диссоциации:
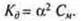
Пример:
при t° = 25° С

Итак, чем больше Кд, тем легче идет распад электролита на ионы, тем больше ионов в его растворе, тем сильнее электролит.
Реакции ионного обмена необратимы, если образуются осадок, газ, вода, слабый электролит:
-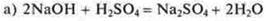
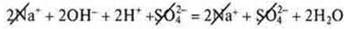 уравнение молекулярного вида
уравнение молекулярного вида
-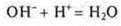 общий ионный вид
общий ионный вид
- слабый электролит воды; уравнение краткого ионного вида
—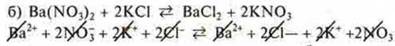 реакция ионного обмена не имеет смысла
реакция ионного обмена не имеет смысла
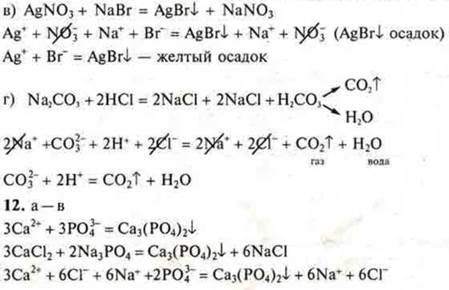
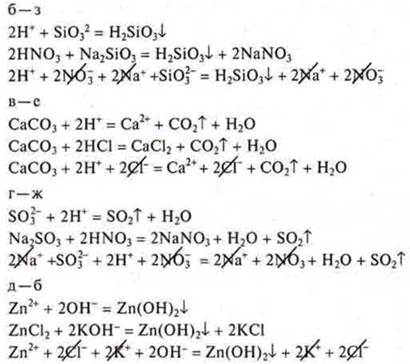
Ионы могут вступать в реакции окислительно-восстановительного взаимодействия с атомами, молекулами.
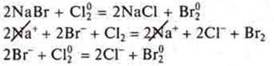
Домашнее задание: конспект
Водородный показатель
Цели: рассмотреть понятие «водородный показатель»; дать представление об ионном произведении воды, константе диссоциации воды, научить применять понятие «водородный показатель» для характеристики среды растворов электролитов и для экспериментального определения среды.
Основные понятия: водородный показатель — pH, ионное произведение воды, кислая, нейтральная, щелочная среды, индикаторы.
Оборудование: индикаторы (метилоранж, фенолфталеин, синий лакмус, универсальный индикатор), растворы кислот, щелочей, вода; раствор мыла (хозяйственного, туалетного), желудочный сок, шампунь, электролиты № 1, 2, 3, пробирки.
Ход занятия:
I. Организационный момент
II. Изучение нового материала
План :
1. Вода — слабый электролит. Диссоциация воды. Константа воды. Ионное произведение воды.
2. а) водородный показатель;
б) среда кислая, щелочная, нейтральная.
3. Качественное определение типа среды. Индикаторы и их реакция на различный тип среды.
4. Характеристика среды в живом организме с использованием водородного показателя.
Вода — очень слабый электролит.
Уравнение диссоциации воды следующее:
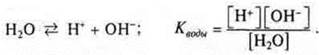
Так как диссоциирует ничтожно малое количество молекул воды, то величина равновесной концентрации воды [Н2O] очень мала, ей можно пренебречь.
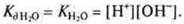
Произведение концентрации катионов водорода и гидроксид-ионов называется ионным произведением воды; при t = 25 °С Кв= 10-14. Эта величина постоянная. Ионное произведение воды дает возможность вычислить концентрации гидроксид-ионов, если известны концентрации катионов водорода и наоборот.
Пример.
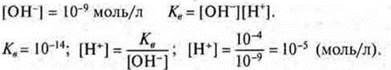
По концентрации ионов водорода гидроксид-анионов различают типы сред:
нейтральная среда — [H+] = [ОН-] = 10-7;
кислотная среда — [Н+] [ОН-] 10-7;
щелочная среда — [Н+] -] -7.
Однако для характеристики сред больше применимо понятие «водородный показатель», pH (пэ-аш), введенное датским химиком Серенсеном. р — от начального слова potent — математическая степень, буква Н — химический знак водорода. pH — водородный показатель называется отрицательным десятичным логарифмом концентрации катионов водорода.
pH = -lg [H+], если [Н+] = 10-8, pH = -lg10-8= 8,
если [Н+] = 10-3; то pH = 3.
Для удобства определения среды по pH используют схему зависимости между концентрацией катионов водорода, значением pH и реакцией среды.
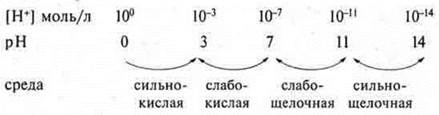
pH = 7 — среда нейтральная;
pH
pH 7 — щелочная среда.
Для качественного определения типа среды, pH водного раствора электролита применяют индикаторы.
И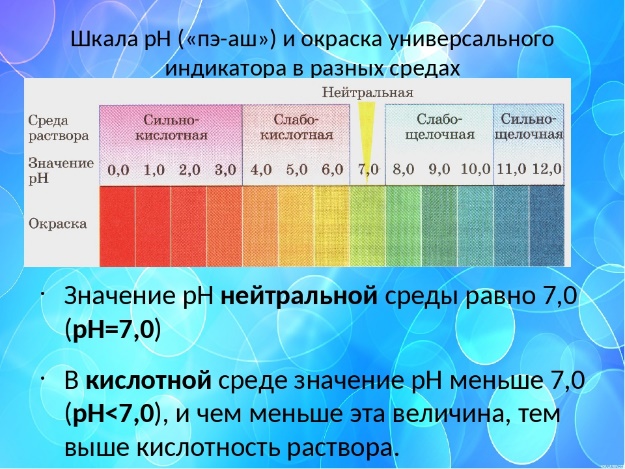 ндикаторы — вещества, изменяющие свой цвет в зависимости от среды раствора.
ндикаторы — вещества, изменяющие свой цвет в зависимости от среды раствора.
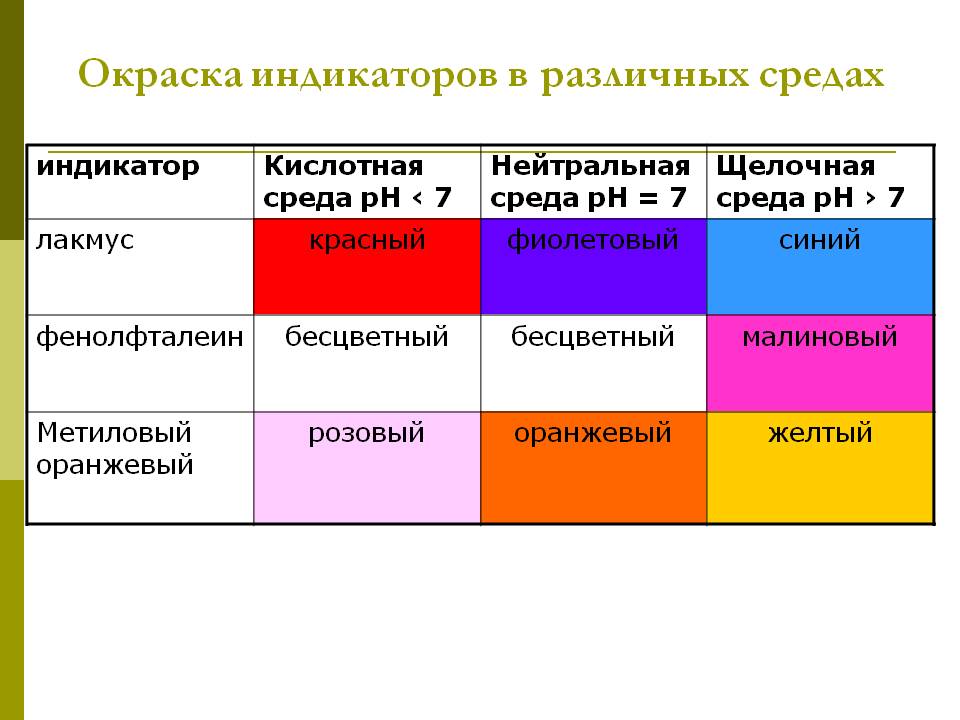
Таким образом, зная pH электролита, можно определить тип среды и объяснить многие процессы протекающих химических реакций с определенной скоростью и направлением в зависимости от среды. Изменяется и скорость, и направление ее протекания.
В живом организме pH не одинакова как на клеточном уровне, так и в межклеточном пространстве: кровь, лимфа, слюна, желудочный сок.
рНкрови = 7,4 — слабощелочная среда;
рНслюны = 7 — близкая к нейтральной;
pHжелудочного сока = 1,7 — сильнощелочная.
От pH зависит и работа фермента-катализатора. Фермент крови каталаза работает при pH = 7, фермент желудочного сока пепсин работает при pH = 1,5—2. Все это важно знать при медицинской диагностике.







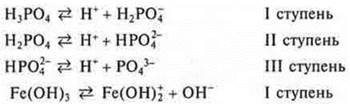


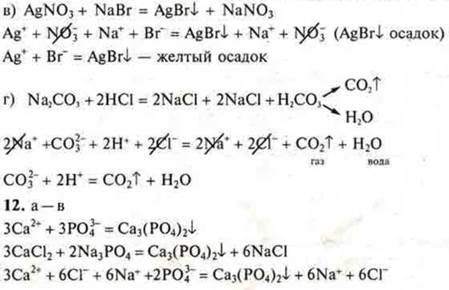
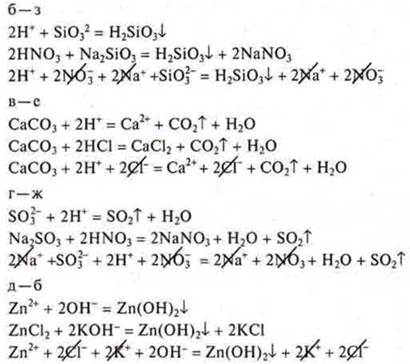
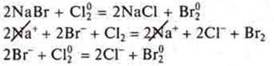
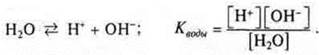
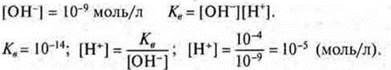

 ндикаторы — вещества, изменяющие свой цвет в зависимости от среды раствора.
ндикаторы — вещества, изменяющие свой цвет в зависимости от среды раствора.










