Лекционный материал для ликвидации пробелов в знаниях по теме: НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА.
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА – соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:

Металлы (от лат. metallum – шахта, рудник): группа элементов, обладающая характерными металлическими свойствами.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.
Металлическая кристаллическая решетка – наличие подвижных электронов
2.Металлический блеск (неметаллы йод и углерод в виде графита)
Наиболее хорошо: алюминий, серебро, палладий и родий.
3. Твёрдое состояние (кроме ртути ).Обладают различной твёрдостью:
щелочные металлы режутся ножом, а ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло, ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
3. Пластичность - возможность лёгкой механической обработки.
Самыми пластичными являются золото, серебро и медь , германий и висмут непластичны.

4. Высокая теплопроводность и электропроводимость обусловлена наличием подвижных электронов.
Серебро, медь и алюминий имеют наибольшую электропроводность.
5. Высокая плотность
Металлы делят на: 1) лёгкие (плотность 0,53 ÷ 5 г/см³) .Самый лёгкий литий (плотность 0.53 г/см³).
2) тяжёлые (5 ÷ 22,5 г/см³). Самые тяжёлые металлы осмий и иридий (около 22.6 г/см³).
6. Температура плавления
лежит в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
В РЕАКЦИЯХ ВСЕГДА ЯВЛЯЮТСЯ ВОССТАНОВИТЕЛЯМИ.
Атомы металлов легко отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы
ВОЗМОЖНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ Ме
Низшая 0,+1,+2,+3
Высшая +4,+5,+6,+7,+8
МЕТАЛЛЫ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А) (ЩЕЛОЧНЫЕ МЕТАЛЛЫ).
литий, натрий, калий, рубидий, цезий, франций
Мягкие металлы, легко режутся ножом.
На срезе белого цвета с блеском, исчезающим на воздух

МЕТАЛЛЫ II ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А)
бериллий, магний, щелочноземельные металлы (кальций, стронций, барий) и радий.

АЛЮМИНИЙ И ЭЛЕМЕНТЫ III-A ГРУППЫ
Алюминий - серебристо-белый легкий металл.
Отличительные особенности алюминия - высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии.

Цинк — элемент побочной подгруппы второй группы (В), четвёртого периода
Хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).

Медь -тяжелый розово-красный металл, мягкий и ковкий.

Железу присущи все металлические свойства:
пластичность
электро- и теплопроводность
характерный металлический блеск.
Металл обладает магнитными свойствами.

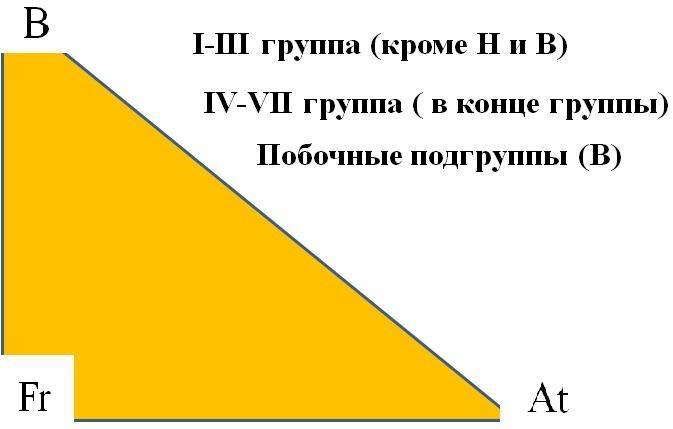
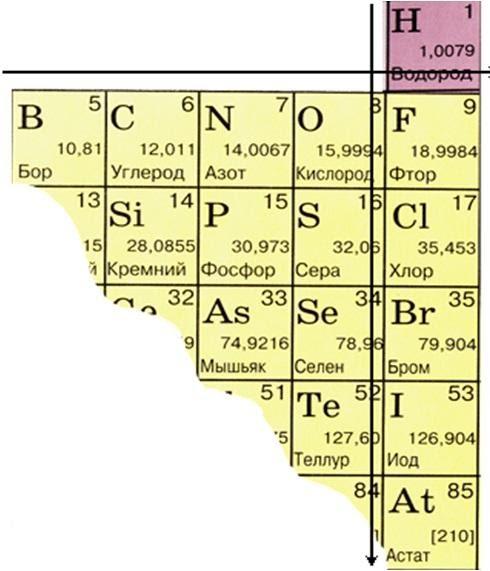
НЕМЕТАЛЛЫ
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ, из них 6 – инертные газы (8A).
Элементы с неметаллическими свойствами находятся в IIIA-VIIA - группах Периодической системы:
Особенности атомного строения неметаллов:
1. Небольшой атомный радиус
2. На внешнем уровне 4-8 электронов (исключение водород – 1 электрон, гелий – 2 электрона)
3. Располагаются только в главных подгруппах
4. Характерно высокое значение ЭО
5. Степени окисления от -4 до +8
Химические связь ковалентная неполярная или вещества атомарного строения
АТОМАРНОЕ СОСТОЯНИЕ
Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии (не образуют решеток)
He –гелий, Ne-неон , Ar-аргон , Kr-криптон , Xe-ксенон , Rn-радон
АТОМНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ: алмаз (С) и кремний (Si)
3. МОЛЕКУЛЯРНАЯ НЕПОЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
Многие неметаллы образуют молекулу, состоящую из двух атомов ( H2 , O2 , N2 , F2, Cl2 , Br2, I2), при этом образуется очень непрочная связь.
При обычной температуре неметаллы могут быть в разном агрегатном состоянии
1. Газообразные - O2-кислород , H2 - водород, N2- азот , Cl2-хлор, F2-фтор.
2. Жидкие - Br2 -бром
3. Твердые – S –сера, P-фосфор, I2 –йод, C–-алмаз и графит
Многие не проводят электрический ток (кроме графита и кремния).
Не проводят тепло.
В твердом состоянии - хрупкие
Не имеют металлического блеска (кроме иода-I2 , графита-C и кремния Si)
Цвет охватывает все цвета спектра: красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода.
Температура плавления изменяется в огромном интервале: tпл (N2)= -210⁰C , а tпл (Алмаз) =3730⁰С

АЛЛОТРОПИЯ
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями, или модификациями.
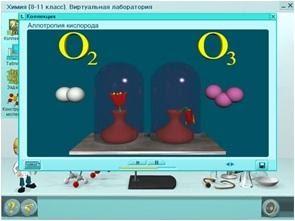
КИСЛОРОД
Кислород образует две аллотропные модификации (причина- строение молекулы)
КИСЛОРОД O₂: Газ без цвета и запаха Входит в состав воздуха (21% по объему). Не ядовит!
ОЗОН O3: Газ бледно-фиолетового цвета с резким запахом свежести.
Обладает бактерицидными свойствами, способен удерживать ультрафиолетовые лучи.
СЕРА
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип = 445 °С
Возможные валентности: II, IV, VI. Степени окисления: -2, 0, +4, +6
У серы можно выделить три аллотропных модификации: кристаллическая (ромбическая),моноклинная и пластическая.
Переход из кристаллической в пластическую происходит при нагревании до температуры кипения при последующем быстром охлаждении.

АЗОТ
Азот – газ без цвета и запаха, плохо растворим в воде. Азот является основной частью воздуха (79% по объѐму).
ФОСФОР
Образует семь аллотропных модификаций, причиной является строение кристаллической решётки.
Фосфор белый P₄( молекулярная кристаллическая решётка )
Мягкое, бесцветное вещество. В темноте светится. Ядовит!
Фосфор красный Pn ( атомная кристаллическая решётка) аморфное
полимерное вещество(порошок). в темноте не светится, ядовит

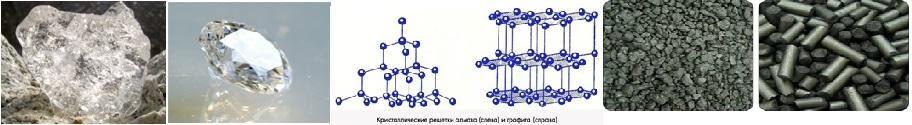
УГЛЕРОД
образует две аллотропные формы (причина – строение кристаллической решётки)
Алмаз: Тетраэдрическая кристаллическая решетка
Бесцветные кристаллы. Самое твердое вещество в природе . tпл=3730ºC
Графит: Кристаллическая решетка напоминает соты
Слоистое кристаллическое вещество, жирное на ощупь , непрозрачное ,серого цвета.