
Диссоциация кислот, щелочей и солей
Разработал Сергеев Сергей Сергеевич, учитель химии МБОУ Первомайская школа №2

«Химический деликатес»
- Слабый электролит
- Сильный электролит
- Катод
- Анод
- Электролитическая диссоциация
- Гидратация
- Катион
- Анион
- Ион
- Электролиты
- Неэлектролиты
- Электропроводность

Поиграем?
1. Анионы
2. Электролитическая диссоциация
3. Катионы
4. Углекислый газ
5. Электролиты
6. Щелочь
7. Не электролиты
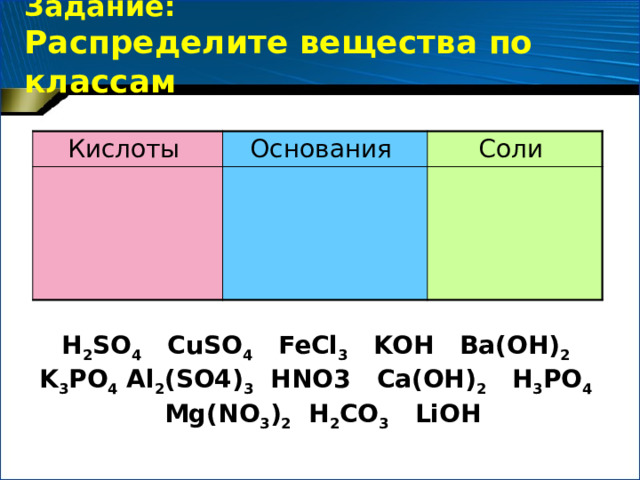
Задание: Распределите вещества по классам
Кислоты
Основания
Соли
H 2 SО 4 CuSO 4 FeCl 3 KOH Ba(OH) 2 K 3 PO 4 Al 2 (SO4) 3 HNO3 Ca(OH) 2 H 3 PO 4 Mg(NO 3 ) 2 H 2 СО 3 LiOH

Проверьте себя:
Кислоты
H2SО4
Основания
KOH
HNO3
Соли
H3PO4
Ba(OH)2
FeCl3
H2СО3
Ca(OH)2
CuSO4
LiOH
K3PO4
Al2(SO4)3
Mg(NO3)2

Тема урока
«Диссоциация кислот, щелочей и солей»

- это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода
Кислоты
Н +
Н +
Н Cl → + Cl -
Н +
Н 2 SO 4 → 2 + SO 4 2-

Общие свойства кислот
- Кислый вкус
- Изменение окраски индикатора
- Взаимодействие с некоторыми металлами с выделением водорода
обусловлены наличием
Н +

Основания
- это электролиты , при диссоциации которых водных растворах в качестве анионов образуются только гидроксид-ионы
ОН -
O Н -
KOH → K + +
O Н -
Ca(OH) 2 → Ca 2+ + 2
O Н -
М e(OH) n → Me n+ + n

Общие свойства щелочей
- Мыльность на ощупь
- Едкое действие
- Изменение окраски индикатора
обусловлены наличием
ОН -

- это электролиты, которые диссоциируют на катион металла и анион кислотного остатка
Соли
Na +
NaCl → +
С l -
K 2 SO 4 → 2 +
K +
SO 4 2-
Al 3+
NO 3 -
Al(NO 3 ) 3 → + 3
Me n+
(кислотный остаток) в-

Na +
С l -
K +
SO 4 2-
Al 3+
Свойства растворов солей
Обусловлены свойствами всех ионов, которые образуются в процессе диссоциации.

Закрепление
- Составьте уравнения диссоциации кислот, оснований и солей из таблицы, которые мы не рассматривали.
Тест «Диссоциация кислот, щелочей и солей»
Вариант 1
Вариант 2
1. Ступенчатой диссоциации подвергается вещество, формула которого:
А) MgCl 2 , б) Ca(OH) 2 , в)HNO3 г)KOH
1. Ступенчатой диссоциации подвергается вещество, формула которого:
А) HNO3 б) НCl в) Н2S г) KOH
2. Соли – это
а) электролиты, диссоциирующие на катион водорода и анион кислотного остатка б) соединения серы; в) электролиты, диссоциирующие на катион металла и анион кислотного остатка, г)соленые вещества.
2. К электролитам не относится вещество, формула которого:
А) NaOH, б) NaCl, в)HNO3 г)FeO
3.Лакмус в кислотах приобретает окраску:
3. Фенолфталеин в щелочах приобретает окраску:
а)синюю; б) красную; в) желтую.
А) синюю, б) красную; в) малиновую.
4. Электролит, который диссоциирует с образованием катиона металла – это:
4. Электролит, который диссоциирует с образованием катиона водорода – это:
А)NaOH, б) NH 3 в)HNO3 г)FeO
а) гидроксид натрия; б) серная кислота; в) нитрат натрия;
5. При диссоциации 1 моль вещества, формула которого K 2 SO 4 ,образуется общее число ионов:
5. При диссоциации 1 моль вещества, формула которого Al (NO 3 ) 3 , образуется общее число ионов:
А) 2 б) 3 в)4 г) 5
А) 2 б) 3 в)4 г)5
Тестирование

Проверь себя
1 вариант
1. б
2. в
3. б
4. а
5. б
2 вариант
1. в
2. г
3. в
4. б
5. в

Подведем итоги
- С какими новыми понятиями вы познакомились?
- Какие трудности вы испытали?
- Какие понятия вы усвоили и можете объяснить другу?
- На сколько процентов из100% вы реализовали свои цели?

Домашнее задание
- §7, учить; тесты, зад. 3 стр.29

































