«ГАЛЬВАНИКАЛЫҚ ЭЛЕМЕНТТЕР»
9.1.1 Гальваникалық элемент және онда жүретін реакциялар
Химиялық реакцияның энергиясы электр энергиясына айналатын электрохимиялық жүйе гальваникалық элемент деп аталады. Қарапайым гальваникалық элемент өз иондарының ерітінділеріне батырылған екі металдық электродтан тұратын жүйе. Ерітінділер өзара ажыратылған және электролиттік көпірше арқылы жалғастырылған. Жұптасқан тотығу-тотықсыздану процестерінің кеңістіктік бөлінген түрде жүруі (тотығу және тотықсыздану) гальваникалық элемент жұмысының негізгі шарты болып табылады. Тотығу процесі бір электродта, ал тотықсыздану процесі екінші электродта жүреді. Гальваникалық элементте теріс зарядталған электродта әрқашан тотығу процесі (электрон беру), ал оң зарядталған электродта тотықсыздану процесі (электрон қосып алу) жүреді.
Мыс-мырыштық гальваникалық элементі ZnSO4 ерітіндісіне батырылған мырыш электроды мен CuSO4 ерітіндісіне батырылған мыс электродынан тұрады. Мыс-мырыштық гальваникалық элементінің сызбасы 9.1 суретте келтірілген. Берілген электрохимиялық жүйеде мырыш электроды оң, ал мыс электроды теріс зарядталған. Мырыш электродында тотығу процесі жүреді:
Zn – 2e = Zn2+, (9.1)
ал мыс электродында тотықсыздану реакциясы жүреді:
Сu2+ + 2e = Cu (9.2)
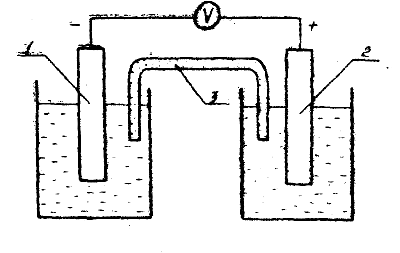
1 – ZnSO4 ерітіндісіне батырылған мырыш электроды;
2 – CuSO4 ерітіндісіне батырылған мыс электроды;
3 – токты жақсы өткізетін электролитпен (KCl немесе AgNO3) толтырылған электролиттік көпірше (кілт).
Сурет 9.1 – Мыс-мырыштық гальваникалық элементінің сызбасы.
Электродтық реакциялардың жиыны гальваникалық элементте жүретін реакцияны береді:
Zn + Cu2+ = Zn2+ + Cu (9.3)
(9.3) реакциясын молекулалық түрде келесідей жазуға болады:
Zn + CuSO4 = ZnSO4 + Cu (9.4)
Гальваникалық элементтің дұрыс жазылған электрохимиялық тізбегінде теріс зарядталған электрод әрқашан сол жағында, ал оң жағында теріс зарядталған электрод орналасады:
(-) Zn/ZnSO4//CuSO4/Cu (+) (9.5)
мұндағы / – электрод-электролит шекарасының белгіленуі;
// – табиғаттары немесе концентрациялары бойынша ерекшеленетін электролиттердің шекараларының белгіленуі.
Гальваникалық элементтің негізгі сипаттамасы оның электр қозғаушы күші (э.қ.к.) болып табылады, ол тізбекте электр тогы жоқ кездегі электродтар арасындағы кернеуге тең. Кез-келген гальваникалық элементтің электр қозғаушы күші оң және теріс зарядталған электродтар потенциалдарының айырымына тең болады:
E = φ+ - φ-, (9.6)
мұндағы Е – гальваникалық элементтің электр қозғаушы күші, В;
φ+ – оң зарядталған электрод потенциалы, В;
φ- – теріс зарядталған электрод потенциалы, В.
Гальваникалық элементтің электр қозғаушы күші әрқашан оң шама болады (Е 0).
Мыс-мырыштық гальваникалық элементінің э.қ.к.-і келесі теңдеумен анықталады:
Е = φ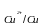 - φ
- φ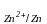 , (9.7)
, (9.7)
мұндағы φ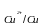 – мыс электродының потенциалы, В;
– мыс электродының потенциалы, В;
φ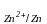 – мырыш электродының потенциалы, В.
– мырыш электродының потенциалы, В.
9.1.2 Гальваникалық элемент электр қозғаушы күшінің потенциал
түзуші иондар концентрациясына тәуелділігі
Гальваникалық элемент электр қозғаушы күші электродтардың өлшеміне, элемент құрылысына тәуелді емес, тек қана гальваникалық элементте жүретін химиялық реакцияның Гиббс энергиясының өзгерісімен анықталады. Мысалы, гальваникалық элементте келесі химиялық реакция жүрсін:
Ме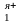 + Me
+ Me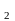 = Me
= Me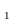 + Me
+ Me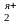 (9.8)
(9.8)
Сонда гальываникалық элементтің электр қозғаушы күші реакцияның Гиббс энергиясының өзгерісімен келесідей байланыста болады:
G = - zFE, (9.9)
мұндағы z – химиялық реакцияға қатысатын электрондар саны.
Вант – Гоффтың изотерма теңдеуіне сәйкес химялық реакция үшін Гиббс энергиясының өзгерісі төмендегідей (9.8) болады:
ΔG = - RTlnKP + RTln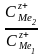 (9.10)
(9.10)
мұндағы КР – химиялық реакцияның тепе-теңдік константасы.
(9.9) және (9.10) теңдеулерін теңгеріп алатынымыз:
- zFE = - RT lnKP + RTln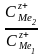 (9.11)
(9.11)
Бұдан:
E = 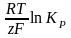 -
- 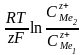 (9.12)
(9.12)
Егер электродтардың потенциалдарын анықтайтын иондар концентрациялары бірге тең, яғни С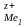 = 1 және С
= 1 және С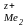 = 1 болса, онда электродтар потенциалдары, сәйкесінше гальваникалық элементтің электр қозғаушы күші стандарттық болады:
= 1 болса, онда электродтар потенциалдары, сәйкесінше гальваникалық элементтің электр қозғаушы күші стандарттық болады:
Сонда
Eo = 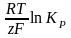 (9.13)
(9.13)
Иондардың концентрациялары бірге тең кезде жұмыс істеп тұрған гальваникалық элементтің электр қозғаушы күші стандарттық деп аталады. Ол берілген гальваникалық элемент электродтарының стандарттық потенциалдарынан есептеледі:
Ео = φ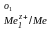
 - φ
- φ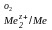 (9.14)
(9.14)
Алдынғы (9.13) теңдеуін ескерсек:
E = Eo - 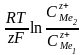 (9.15)
(9.15)
Егер электролит ерітіндісі реалдық болса, онда гальваникалық элемент электр қозғаушы күшінің иондар концентрациясына тәуелділігі иондардың активтілігі арқылы өрнектеледі:
E = Eo - 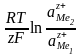 (9.16)
(9.16)
9.1.3 Қаныққан Вестон элементі
Гальваникалық элементтердің электр қозғаушы күштерін өлшеуде эталон болып саналатын қаныққан Вестон элементі жиі қолданылады. Қаныққан Вестон элементі бұл сынапты–кадмийлік элемент (сурет 9.2). элементтің теріс зарядталған электроды – кадмий амальгамасы, ол CdSO4 ерітіндісіне батырылған. Оң зарядталған электрод металдық сынап, ол Hg2SO4 тұзымен қапталып, қаныққан CdSO4 ерітіндісіне батырылған. Ерітіндіде CdSO4 ∙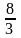 Н2О тұзының кристалдары болады. Осылайша гальваникалық элементтің екі электроды да бір электролиттің CdSO4 және Hg2SO4 тұздарына қаныққан ерітіндісіне батырылған болып шығады. Электролит ерітіндісі CdSO4∙
Н2О тұзының кристалдары болады. Осылайша гальваникалық элементтің екі электроды да бір электролиттің CdSO4 және Hg2SO4 тұздарына қаныққан ерітіндісіне батырылған болып шығады. Электролит ерітіндісі CdSO4∙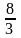 Н2О кристаллогидратымен тепе-теңдікте болады, және кристалдар ыдыстың көп бөлігін алады. Олар температура өзгергенде ерітіндінің қанығуын қамтамасыз етеді, себебі ерігіштігі біршама жоғары.
Н2О кристаллогидратымен тепе-теңдікте болады, және кристалдар ыдыстың көп бөлігін алады. Олар температура өзгергенде ерітіндінің қанығуын қамтамасыз етеді, себебі ерігіштігі біршама жоғары.
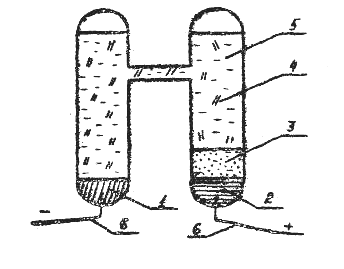
1 – кадмий амальгамасы (Сd 12,5%);
2 – металдық сынап;
3 – қатты аз еритін Hg2SO4 тұзынан жасалған паста;
4 – CdSO4∙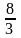 Н2О кристалдары;
Н2О кристалдары;
5 – қаныққан CdSO4 ерітіндісі;
6 – платина токөткізгіштері.
Сурет – 9.2 – Қаныққан Вестон элементінің сызбасы.
Вестон элементінің ерекшелігі сол оның электр қозғаушы күші уақытқа тәуелді емес, тек қана температурамен анықталады. Вестон элементінің электр қозғаушы күшінің температураға тәуелділігі төмендегі теңдеумен сипатталады:
E = 1,0183 – 4,06 10-5(Т – 293K) (9.17)
Сонымен қатар, Вестон элементінің электр қозғаушы күші жақсы қайталанады. Сондықтан бұл элемент халықаралық эталон ретінде қабылданған.
Вестон элементінің электрохимиялық тізбегін келесідей беруге болады:
(-)Hg,Cd/CdSO4 (қан.)∙ /Hg2SO4
Гальваникалық элементтің теріс зарядталған электродында келесі реакция жүреді :
Сd – 2e = Cd 2+ (9.18)
ал элементтің оң зарядталған электродында тотықсыздану реакциясы жүруі тиіс:
Hg2SO4 + 2е = 2Hg + 2ОН- (9.19)
Вестон гальваникалық элементінде жүретін жиынтық реакция осы электродтық реакциялар қосындысы болып табылады, яғни:
Сd + Нg2SO4 +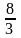 Н2О =CdSO4∙
Н2О =CdSO4∙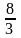 Н2О + 2Hg (9.20)
Н2О + 2Hg (9.20)







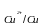 - φ
- φ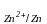 , (9.7)
, (9.7)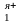 + Me
+ Me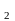 = Me
= Me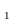 + Me
+ Me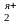 (9.8)
(9.8)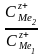 (9.10)
(9.10)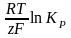 -
- 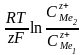 (9.12)
(9.12)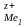 = 1 және С
= 1 және С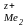 = 1 болса, онда электродтар потенциалдары, сәйкесінше гальваникалық элементтің электр қозғаушы күші стандарттық болады:
= 1 болса, онда электродтар потенциалдары, сәйкесінше гальваникалық элементтің электр қозғаушы күші стандарттық болады: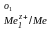
 - φ
- φ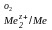 (9.14)
(9.14)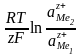 (9.16)
(9.16)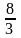 Н2О тұзының кристалдары болады. Осылайша гальваникалық элементтің екі электроды да бір электролиттің CdSO4 және Hg2SO4 тұздарына қаныққан ерітіндісіне батырылған болып шығады. Электролит ерітіндісі CdSO4∙
Н2О тұзының кристалдары болады. Осылайша гальваникалық элементтің екі электроды да бір электролиттің CdSO4 және Hg2SO4 тұздарына қаныққан ерітіндісіне батырылған болып шығады. Электролит ерітіндісі CdSO4∙










