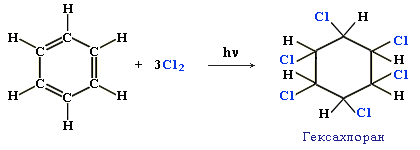еличие человека состоит из его способности к действию и из правильного приложения сил к тому, что надлежит сделать. Фредерик Дуглас
Майкл Фарадей
(1791-1867) – великий ученый и изобретатель.

Цель работы:
1. Ознакомить учащихся с опытами Майкла Фарадея, его достижениями в области химии и физики, а также с биографией великого изобретателя.
2. Расширить представления учащихся об электролизе.
3. Использовать данный проект на внеклассном мероприятии по химии и физике 9-11 классах

Содержание
- Введение
- Детство и юность
- Начало работы в Королевском институте
- Путешествия по Европе
- Первые самостоятельные исследования
- Личная жизнь
- Избрание в Королевское общество
- Открытия в области физики
- Электромагнитная индукция Эксперимент Магнитное поле Эксперимент
- Электромагнитная индукция
- Эксперимент
- Магнитное поле
- Эксперимент
9. Открытия в области химии
- Открытие нержавеющей стали Получение бензола Получение хлора Получение гексахлорана Электролиз Эксперименты
- Открытие нержавеющей стали
- Получение бензола
- Получение хлора
- Получение гексахлорана
- Электролиз
- Эксперименты
10. Популяризация достижений
11. Последние годы жизни
12. В память о великом ученом

"Никогда со времен Галилея свет не видал стольких поразительных и разнообразных открытий, вышедших из одной головы"
А.Г.Столетов
«Точка зрения на электродинамику с позиций концепции поля, основоположником которой был Фарадей, стала неотъемлемой частью современной науки. Труды Фарадея ознаменовали наступление новой эры в физике»
В.Н. Григорьев
Майкл Фарадей
(1791-1867)

Детство и юность изобретателя
Майкл Фарадей родился 22 сентября 1791 года в окрестностях Лондона в семье кузнеца. Мать Фарадея, трудолюбивая, мудрая, хотя и необразованная женщина, дожила до времени, когда ее сын добился успехов и признания, и по праву гордилась им.
(Майкл со своей матерью Маргаритой Фарадей)

Детство и юность изобретателя
Скромные доходы семьи не позволили Майклу окончить даже среднюю школу. В девять лет ему пришлось работать разносчиком газет, и в тринадцать лет он поступил учеником к владельцу книжной лавки и переплетной мастерской. Когда ему исполнилось девятнадцать лет, он случайно узнал о лекциях по естествознанию некоего мистера Татума. Посетив 13 лекций, он решил сам заняться наукой.

Начало работы в Королевском институте
Один из клиентов переплетной мастерской, член Лондонского королевского общества Дено , заметив интерес Фарадея к науке, помог ему попасть на лекции выдающегося физика и химика Гемфри Дэви в Королевском институте, который позже стал его учителем и наставником.
( Гемфри Дэви , оказавший огромное значении на жизнь юного Майкла)

Начало работы в Королевском институте
В 1813 году Дэви пригласил Фарадея на освободившееся место ассистента в Королевский институт.
(Королевский институт – будущее место работы и великих открытий Майкла)

Путешествия по Европе
Осенью 1813 года Дэви берет Фарадея в путешествие по научным центрам Европы.
Фарадей о своём путешествии: «Это утро - начало новой эпохи в моей жизни. До сих пор, насколько мне помнится, я не отъезжал от Лондона на расстояние больше двадцати миль».
Ампер Андре Мари

Начало работы в Королевском институте
Жизнь Фарадея с тех пор, как он вступил в Королевский институт, сосредоточивалась, главным образом, на лаборатории и научных занятиях. Кредо его жизни было: « Наблюдать, изучать и работать».

Первые самостоятельные исследования. Научные публикации
В 1816 он начал читать публичный курс лекций по физике и химии в Обществе для самообразования. В этом же году появляется и его первая печатная работа.

Фарадей влюбляется…
В 1921 Майкл женился на Сарре Бернард . « Это обстоятельство, - как он писал сам о себе, - содействовало его земному счастью и здоровью ума».
В дальнейшей жизни Фарадей был весьма счастлив в браке.

Избрание в Королевское общество. Профессура
В 1824 Майкл Фарадей был избран членом Королевского общества. Спустя год после избрания в Королевское общество Майкла Фарадея назначают директором лаборатории Королевского института, а в 1827 он получает в этом институте профессорскую кафедру.
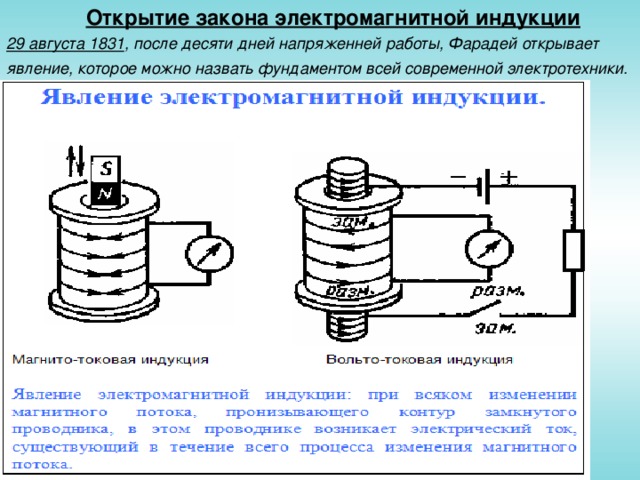
Открытие закона электромагнитной индукции
29 августа 1831 , после десяти дней напряженней работы, Фарадей открывает явление, которое можно назвать фундаментом всей современной электротехники.

Опыты по электромагнитной индукции
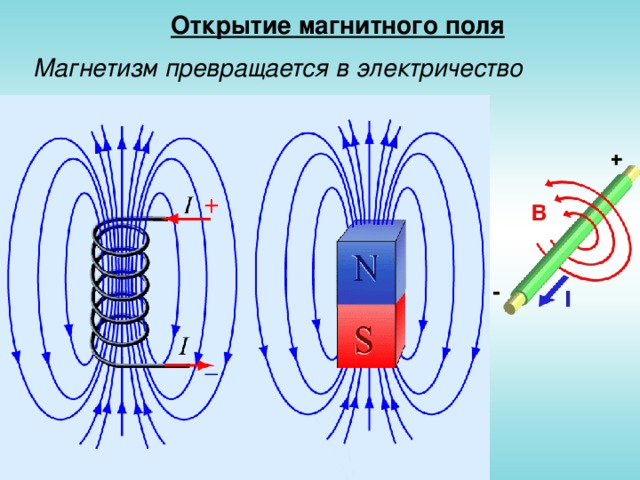
Открытие магнитного поля
Магнетизм превращается в электричество

Спектр магнитных полей
Противоположные полюса разных магнитов притягиваются – северный к южному и наоборот

Открытие нержавеющей стали
В 1820 г. Фарадей провёл несколько опытов по выплавке сталей, содержащих никель. Эта работа считается открытием нержавеющей стали, которое не заинтересовало в то время металлургов.

Получение жидкого хлора
В 1823г. Майкл Фарадей получает жидкий хлор ( t кипения = -34 о С, t плавления = -100 о С) , а затем обращает в жидкость аммиак, закись азота, углекислый газ, двуокись серы, сероводород, и хлористый водород.

Получение гексахлорана
В 1825 г Майкл Фарадей впервые синтезирует бензол и гексахлоран — вещества, на основе которых в XX веке изготовлялись различные инсектициды.

Два электрохимических закона
В 1832 г. Фарадей открывает электрохимические законы , которые ложатся в основу нового раздела науки — электрохимии , имеющего сегодня огромное количество технологических приложений.

1-ый электрохимический закон
Количество электричества необходимо пропорционально количеству химического действия:
M=k×Q=k×I × t
Первый закон Фарадея записывается в следующем виде:
где — M - молярная масса данного вещества
— I - сила тока , пропущенного через вещество
— t - время , в течение которого проводился электролиз
— k – коэффициент пропорциональности
— Q – удельная теплота

2-ой электрохимический закон
Количество электричества, необходимое для разложения различных веществ, всегда обратно пропорционально атомному весу вещества
Второй закон Фарадея записывается в следующем виде:
где — M - молярная масса данного вещества
— I - сила тока , пропущенного через вещество
— t - время , в течение которого проводился
электролиз
— F - постоянная Фарадея
— n - число участвующих в процессе электронов

Электролиз раствора сульфата меди на медных электродах

Немного практики…
В 1833-34 Майкл Фарадей изучал прохождение электрических токов через растворы кислот, солей и щелочей, что привело его к открытию законов электролиза . И вот некоторые задачки, решаемые применением формул законов Фарадея по теме «Электролиз»
Задача 1
Через раствор сульфата меди в течение 2 часов пропускали постоянный ток силой 0,5 A . Какова масса осевшего на катоде металла, если выход по току составляет 85%?
Задача 2
В результате электролиза избытка раствора соли на катоде с выходом 87% образовалось 5,626 г металла. Электролиз проводился в течение 2 часов при силе тока 5 A . Что за металл выделился на катоде?

Популяризация достижений
Помимо фундаментальных исследований в науке, Фарадей много занимался популяризацией её достижений, его книга «История свечи» (1861г.) переведена почти на все языки мира.

Последние годы великого изобретателя…
В 1855 болезнь вновь заставила Фарадея прервать работу. Он значительно ослабел, стал катастрофически терять память.
Майкл Фарадей умер 25 августа 1867 года, семидесяти семи лет от роду, оставив после себя огромный клад знаний и открытий.

В последний путь…
Похороны великого ученого были незаметными, в соответствии с его желанием присутствовали только ближайшие родственники и друзья. На могиле Фарадея — простой камень. Но нация справедливо определила место его захоронения — Вестминстерское аббатство, рядом с могилами Ньютона и Максвелла.

Ничто не забыто…
После смерти Майкла Фарадея, возле Королевского института, был воздвигнут бронзовый памятник великому изобретателю. В настоящее же время в Королевском институте открыт музей имени Фарадея.