ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
КАМЧАТСКОГО КРАЯ
«КАМЧАТСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ЛЕКЦИИ
По дисциплине «Химия»
По теме: «Органические и неорганические кислоты»
Для специальности: 34.02.01 Сестринское дело
Уровень подготовки базовый
| Рассмотрена на заседании цикловой комиссии общепрофессиональных дисциплин Протокол № ____ «__» ___________ 2024 г. Председатель ЦМК ____________/ Г.В. Яковишин | УТВЕРЖДАЮ Заместитель директора по УПР __________/Н.В. Вострикова «___» ______ 2024 г. |
Составитель:
Потапова Елена Витальевна – преподаватель высшей квалификационной категории ГБПОУ КК «Камчатский медицинский колледж»
Петропавловск-Камчатский, 2024
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическая разработка лекции по теме «Органические и неорганические кислоты» разработана в соответствии с ФГОС СПО специальности 34.02.01 «Сестринское дело» и рассчитано на одно занятие (2 часа) в соответствии с календарно-тематическим планом программы учебной дисциплины.
Данная тема входит в изучение общеобразовательной дисциплины профильного уровня «Химия». Преподавание реализовано с учётом профессиональной направленности обучающихся по специальности 34.02.01 «Сестринское дело».
Актуальность темы:
Кислоты – необходимые для жизни человека химические соединения. Вместе с едой мы получаем растительные и животные белки, которые расщепляются на отдельные аминокислоты. Из аминокислот в каждом организме строятся свои белковые структуры, свои живые ткани. Органические кислоты в свободном виде поступают в человеческий организм с молочнокислыми продуктами, ягодами, фруктами, овощами. Некоторые органические кислоты являются витаминами. В организме человека есть и неорганические кислоты. Они либо вырабатываются в организме, либо поступают с пищей. Серная, азотная, соляная и фосфорная кислоты – важнейшие продукты химической промышленности. В наших квартирах можно встретить кислоты, и чтобы они не причиняли вред нам, очень важно знать, как с ними обращаться и можно ли их заменить на менее вредные для здоровья средства.
Тип учебного занятия: лекция
Цели занятия:
Учебные:
- дать представление о кислотах неорганических и органических соединениях;
- научить записывать уравнение диссоциации неорганических и органических кислот;
- обобщить знания о классификации кислот, номенклатуре, физических свойствах и химических свойствах;
- показать практическое значение кислот в природе и жизни человека.
Развивающие:
способствовать развитию клинического и логического мышления, медицинской наблюдательности;
способствовать развитию умения сравнивать и выделять различия;
развивать познавательную и поисковую активность.
Воспитательные:
способствовать повышению интереса к предмету, образовательному процессу, самостоятельной работе;
содействовать личностному самоопределению обучающихся в отношении их будущей профессии.
Обучающийся должен обладать общими компетенциями, включающими в себя способность:
ОК 01. Выбирать способы решения задач профессиональной деятельности применительно к различным контекстам;
ОК 04. Эффективно взаимодействовать и работать в коллективе и команде;
ОК 05. Осуществлять устную и письменную коммуникацию на государственном языке Российской Федерации с учетом особенностей социального и культурного контекста;
ОК 08. Использовать средства физической культуры для сохранения и укрепления здоровья в процессе профессиональной деятельности и поддержания необходимого уровня физической подготовленности.
Занятие способствует формированию у обучающихся следующих личностных результатов:
ЛР.12 Способный искать нужные источники информации и данные, воспринимать, анализировать, запоминать и передавать информацию с использованием цифровых средств; предупреждающий собственное и чужое деструктивное поведение в сетевом пространстве.
ЛР.13 Проявляющий навыки сотрудничества со сверстниками, детьми младшего возраста, взрослыми в образовательной, общественно полезной, учебно-исследовательской, проектной деятельности.
ЛР.14 Развивающий творческие способности, способный креативно мыслить.
ЛР.21 Соблюдающий и пропагандирующий правила здорового и безопасного образа жизни, спорта; предупреждающий либо преодолевающий зависимости от алкоголя, табака, психоактивных веществ, азартных игр и т.д.
ЛР.26 Готов к выполнению поставленной задачи, направленной на помощь пациенту в любой ситуации.
Обучающийся (базовый уровень) должен обладать элементами следующих профессиональных компетенций:
ПК 1.1. Организовывать рабочее место.
ПК 1.2. Обеспечивать безопасную окружающую среду.
ПК 3.2. Пропагандировать здоровый образ жизни.
После изучения данной темы обучающийся должен:
уметь:
- формулировать понятия кислоты;
-записывать молекулярные формулы, диссоциацию кислот;
– характеризовать общие химические свойства кислот;
–объяснять зависимость свойств кислот от классификации и состава;
– называть изученные вещества;
– определять принадлежность веществ к разным классам неорганических и органических соединений; типы реакций в неорганической и органической химии;
– характеризовать общие химические свойства кислот органических и неорганических соединений;
– объяснять практическое применение и значение кислот в биохимических реакциях организма.
знать:
- Классификацию кислот по составу (одноосновные, двухосновные, трехосновные).
- Классификацию кислот (сильные и слабые).
- Классификацию кислот (растворимые и нерастворимые).
- Значение кислот в живом организме, в природе, в быту.
Междисциплинарные связи:
ОДП.03 Биология
ОП.01 Анатомия и физиология человека
ПМ.01 Проведение мероприятий по профилактике инфекций, связанных с оказанием медицинской помощи.
Методы организации и осуществления учебно-познавательной деятельности:
словесный (лекция, объяснение, фронтальная беседа);
наглядный (демонстрация таблиц, мультимедийной презентации, видеофрагментов)
Место проведения лекции: учебная аудитория ГБПОУ КК «Камчатский медицинский колледж».
Материально-техническое оснащение занятия:
СТРУКТУРНО-ЛОГИЧЕСКАЯ СХЕМА ЗАНЯТИЯ
| Этапы занятия | Время | Действия преподавателя | Действия обучающихся |
| Организационный момент | 2 | Приветствует обучающихся, осуществляет контроль присутствия на занятии, готовности к занятию учебного кабинета и обучающихся, оценивает внешний вид обучающихся. | Занимают рабочие места, приветствуют преподавателя, слушают, отвечают |
| Сообщение темы, определение целей, плана проведения занятий. | 3 | Сообщает тему, задает вопросы, побуждающие к обсуждению актуальности изучаемой темы. Организует обсуждение. | Записывают тему, участвуют в обсуждении. |
| Актуализация опорных знаний | 5 | Проводит опрос | Отвечают на вопросы |
| Изучение нового материала | 30 | Объясняет новый материал | Конспектируют материал лекции, составляют схему |
| Физкультминутка | 5 | Демонстрирует студентам технику выполнения упражнений (Приложение №А) | Выполняют упражнения |
| Просмотр видеофрагмента | 15 | Видеоурок «Кислоты» (РЭШ, https://resh.edu.ru/subject/lesson/2055/main/
| Смотрят, конспектируют. Разбирают уравнения составления гидролиза |
| Составления уравнений гидролиза | 20 | Объясняет задание | Выполняют в тетради |
| Рефлексия | 5 | Проводит рефлексию | Отвечают на вопросы: Я не знал, но теперь знаю… Для меня сегодня самым интересным было разобраться в …. |
| Сообщение задания для внеаудиторной самостоятельной работы. Выставление оценок. | 5 | Объясняет выполнение внеаудиторной самостоятельной работы: 1) Учить материал лекции | Записывают задание для выполнения |
| ИТОГО: | 90 |
|
Ход занятия
Основные понятия: кислородсодержащие и бескислородные кислоты, основность кислот, летучая и нелетучая кислота, сильная и слабая кислота, стабильная и нестабильная кислота, электрохимический ряд напряжений металлов.
Актуализация знаний:
Перечислите основные классы неорганических соединений? (оксиды, соли, основания, кислоты).
Какие Кислоты бывают, перечислите? (сильные, слабые, растворимые и нерастворимые, кислородосодержащие и бескислородные),
Дайте вспомним понятие диссоциация? (Электролитическая диссоциация — это процесс распада электролита на ионы.)
Дайте определение понятию «Электролит» (Электролит — это вещества, которые в растворе или в расплаве распадаются на свободные ионы (подвергаются электролитической диссоциации), вследствие чего их расплавы и растворы проводят электрический ток (обладают ионной проводимостью).
Кислоты — это сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металла и кислотного остатка. Общая формула: НnAс.
Кислоты бескислородные:
HCl — соляная кислота,
H2S — сероводородная кислота.
Кислоты кислородсодержащие:
H2SO4 — серная кислота;
Н3РO4 — ортофосфорная (фосфорная) кислота;
H2SO3 — сернистая кислота;
HNO2 — азотистая кислота;
СН3СООН — уксусная кислота, этановая кислота;
НСООН — метановая кислота (муравьиная кислота):
С17Н35СООН — стеариновая кислота.
Пример: (H2SO4 — серная кислоты, кислородсодержащая, двухосновная, растворимая, нелетучая, сильная, стабильная.
HCl — соляная кислота, бескислородная, одноосновная, растворимая, сильная, летучая, стабильная.
H2S — сероводородная кислота, бескислородная, двухосновная, растворимая, слабая, летучая, стабильная.
H2SO3 — сернистая кислота, кислородсодержащая, двухосновная, растворимая, нестабильная, нелетучая, слабая.
СН3СООН — этановая (уксусная) кислота, кислородсодержащая, одноосновная, растворимая, летучая, слабая, стабильная.
HNO2 — азотистая кислота, кислородсодержащая, одноосновная, растворимая, слабая, нелетучая, стабильная.
НСООН — метановая (муравьиная) кислота, кислородсодержащая, одноосновная, растворимая, летучая, слабая, стабильная.
С17Н35СООН — стеариновая кислота, кислородсодержащая, нерастворимая, нелетучая, слабая, стабильная.)
Кислоты — это электролиты, в водных растворах которых в качестве катиона присутствует катион водорода:
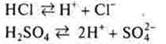
В 1923 г. была предложена протеолитическая теория Бернстедом-Лаури, которая расширила представления о кислотах и основаниях. Эта теория объясняла поведение веществ в водных и неводных растворах.
Согласно этой теории кислоты — это молекулы или ионы, которые являются в данной реакции донорами (дающие) катионов водорода Н+:
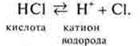
Кислота — донор катиона водорода. Катион водорода называется протоном, поэтому теория называется протеолитической.
Согласно электронной теории кислот и оснований американского химика Г. Н. Льюиса один из соединяющихся атомов отдает на образование химической связи свою свободную электронную пару, а другой атом предоставляет свою свободную электронную ячейку (орбиталь). Первый атом — донор электронов, второй атом — акцептор (принимающий) — идет образование химической связи по донорно-акцепторному механизму.
В соответствии с этим Г.Н. Льюис сформулировал новое представление о кислотах и основаниях. Кислоты — те реагенты, которые являются акцепторами электронов. Основания — те реагенты, которые выступают донорами электронных пар.
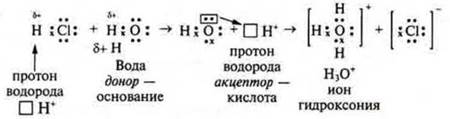
Н3O+ — ион гидроксония. Присутствует в растворах всех кислот, но и он может выступать в роли кислоты — отдавать протон и превращаться в молекулу воды. В уравнениях реакций для простоты записи будем пользоваться обозначением иона гидроксония — Н+.
Общие химические свойства кислот органических и неорганических: кислый вкус, изменение цвета индикаторов, взаимодействие с металлами, оксидами основными и амфотерными, основаниями растворимыми и нерастворимыми, солями, обусловлены катионами водорода в растворах.
Изменение цвета индикаторов:
а) метилоранж — розовый цвет;
б) фенолфталеин — без изменений;
в) синий лакмус — красный цвет;
г) универсальный индикатор — от желтого до розового цвета.
Химические свойства кислот
1.Взаимодействия с металлами, расположенными в электрохимическом ряду напряжений металлов до водорода.
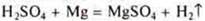 - неорганическая кислота
- неорганическая кислота
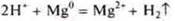
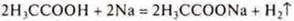 - органическая кислота
- органическая кислота
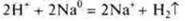
2.Взаимодействие с основными и амфотерными оксидами
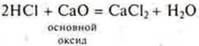 - неорганическая кислота
- неорганическая кислота
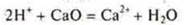
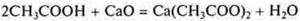 — органическая кислота
— органическая кислота
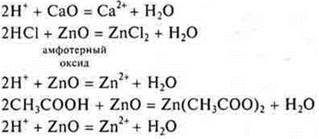
3.Взаимодействие с растворимыми и нерастворимыми основаниями
Многоосновные кислоты могут образовывать кислые соли и средние соли. Это реакции нейтрализации.
Растворимое основание:
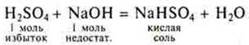 — кислота неорганическая
— кислота неорганическая
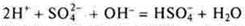 — кислота неорганическая
— кислота неорганическая
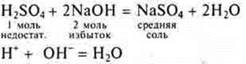
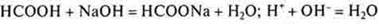 - органическая кислота
- органическая кислота
Нерастворимое основание
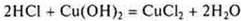 — кислота неорганическая
— кислота неорганическая
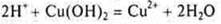
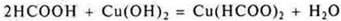 — органическая кислота
— органическая кислота
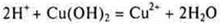
4.Взаимодействие с солями
Следует помнить, что сильная кислота способна вытеснить слабую кислоту даже из нерастворимой соли.
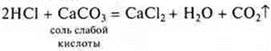 — неорганическая кислота
— неорганическая кислота
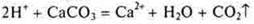 — образуются газ, вода
— образуются газ, вода
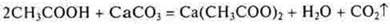
 — органическая кислота
— органическая кислота
Обобщение общих химических свойств неорганических и органических кислот следует записать в виде схемы.
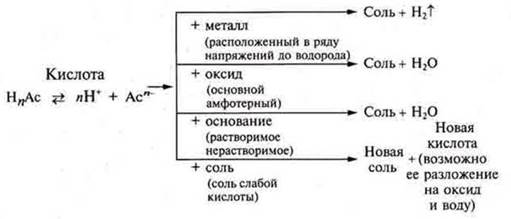
Специфические свойства неорганических и органических кислот
- Специфические свойства H2SО4(к) и HNО3(к), (р).
- Специфические свойства некоторых органических кислот.
Отдельные представители неорганических кислот обладают сильными окислительными свойствами к металлам, неметаллам, сложным соединениям.
Это вызвано тем, что в серной кислоте H2SО4 сера находится в максимальной С.О., в азотной кислоте HNO3 азот находится в максимальной С.О. +5.
По электрохимическому ряду напряжений металлов разделим все металлы на три группы: от Li до Al — очень активные металлы, от Аl до Н2 — металлы средней активности, от Н2 до Au — малоактивные металлы.
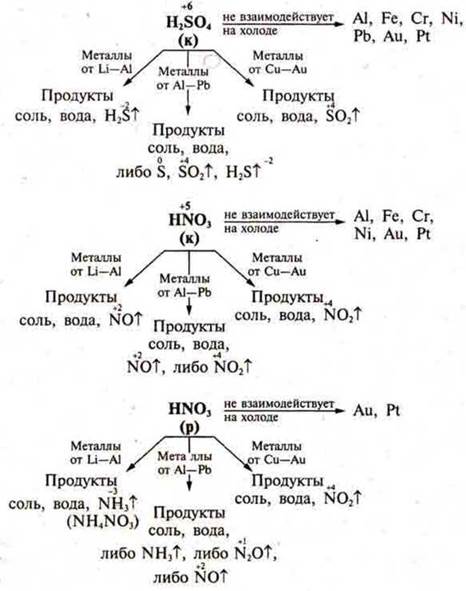
Неметалл окисляется до оксида или кислоты.
При взаимодействии с H2SO4(k) образуются оксиды окисляемых неметаллов, а если окисляется фосфор — то кислота фосфорная, сера восстанавливается до оксида серы (IV).
С HNO3(k) азот всегда восстанавливается до оксида азота (IV), а неметаллы до оксидов или кислот.
С HNO3(p) азот восстанавливается до оксида азота (II), а неметаллы до оксидов или кислот.
Пример: Сu — малоактивный металл.
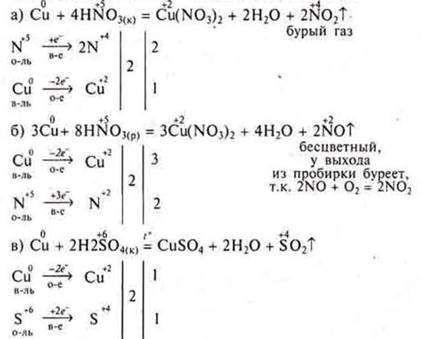
Окисление неметаллов:

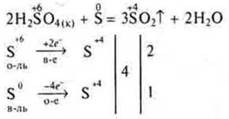
Окисление сложных веществ:
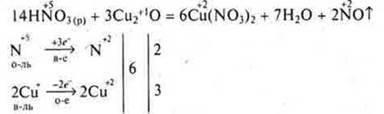
Неорганические кислоты взаимодействуют с органическими веществами: реакции нитрования, сульфирования; нитрование — взаимодействие органических веществе азотной кислотой. Пример: нитрование бензола, нитрование целлюлозы. При нитровании целлюлозы образуются ди- и тринитроцеллюлозы — сложные эфиры, очень необходимые вещества для производства бездымного пороха.
Специфические свойства органических кислот
1.Взаимодействие со спиртами с образованием сложных эфиров.
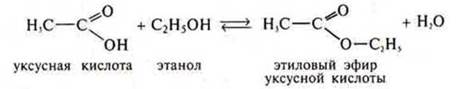
2.Органические кислоты вступают в реакции замещения по радикалу.
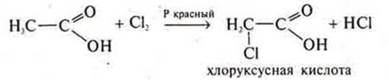
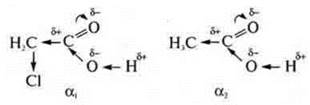
Введение в радикал молекулы кислоты атома галогена увеличивает степень диссоциации в 100 раз.
Cl — самый электроотрицательный элемент в соединении и смешает электронную плотность от углерода в свою сторону, вследствие чего уменьшается электронная плотность у атома углерода, он приобретает еще больший δ+, чем в уксусной кислоте. Атом кислорода в группе —ОН с большей силой свою электронную плотность смешает в сторону углерода № 2, делая тем самым очень подвижным атом водорода.
Некоторые органические кислоты обладают двойственным свойствами.
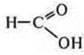 — метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.
— метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.
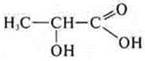 - молочная кислота, также обладает двойственными свойствами — это спиртокислота.
- молочная кислота, также обладает двойственными свойствами — это спиртокислота.
Некоторые кислоты проявляют восстановительные свойства.
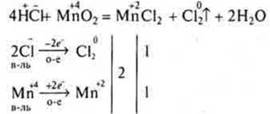
Выводы:
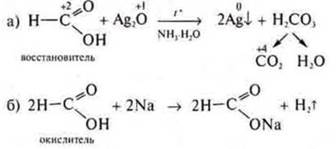
Неорганические и органические кислоты обладают специфическими свойствами. В зависимости отсоединений, с которыми они взаимодействуют, и условий течения реакций они могут проявлять окислительно-восстановительные свойства. Многие кислоты, особенно органические, могут обладать не только свойствами нескольких классов органических веществ, но и проявлять окислительно-восстановительные свойства.
Пример:
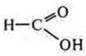 — восстановитель, взаимодействуя с Ag2O(NH3 · Н2O);
— восстановитель, взаимодействуя с Ag2O(NH3 · Н2O);
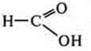 — окислитель, взаимодействуя с металлами.
— окислитель, взаимодействуя с металлами.
Задания для самостоятельной работы студентов:
1. Впишите пропущенные слова.
1) Кислоты – это сложные  , состоящие из атомов
, состоящие из атомов  ,
,
связанных с  .
.
2) Кислоты, содержащие в составе  атомы кислорода,
атомы кислорода,
называются  .
.
3) Кислоты, не имеющие в составе  атомов кислорода,
атомов кислорода,
называются  .
.
2. Какие вещества являются кислотами?
 NaNO3
NaNO3 H2S
H2S HOH
HOH HClO4
HClO4 CH4
CH4
3. Распределите вещества в соответствующие колонки.
| Кислородосодержащие кислоты | Бескислородные кислоты |
|
|
|
Серная кислота, Бромоводородная кислота, Соляная кислота, Азотная кислота, Сероводородная кислота, Кремниевая кислота, Марганцевая кислота
Фтороводородная кислота, Лимонная кислота, Уксусная кислота, Щавелевая кислота.
II. Обобщение и выводы
Мы вспомнили из курса химии общеобразовательного курса школы основные понятия кислоты, химические свойства и применение.
Познакомились с более расширенной классификацией органических и неорганических кислот и значение в биохимических реакциях. Рассмотрели более подробно применение кислот в медицине.
Лимонная. Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса), что способствует ускорению метаболизма. При похмелье рассматривается токсикологами как мера химической дезинтоксикации. В косметике используется как регулятор кислотности, буфер, хелатирующий агент, для шипучих композиций (ванны). X
Соляная. Составная часть желудочного сока; разведенную соляную кислоту ранее назначали внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока. Соляная кислота - сильный бактерицид. Большинство бактерий, попавших в желудок с пищей, погибают под ее действием. Так что врачи не случайно тревожатся, если у пациента пониженная кислотность желудочного сока.
Щавелевая. Применяется в фармацевтике, в косметике применяется как активная добавка в отбеливающих кремах от веснушек. В народной медицине используется как противоцинготное средство, для улучшения пищеварения, поднятия аппетита, как мочегонное и кровоочистительное средство.
Яблочная. Для производства слабительного и лекарств от хрипоты; - как один из компонентов косметических препаратов.
Молочная. В концентрированном виде молочная кислота применяется для прижигания бородавок и удаления мозолей. Входит в состав средств для удаления кутикулы. Ценным качеством молочной кислоты является то, что она действует на ороговевшие участки эпидермиса, мало повреждая при этом обычную кожу. В косметике и народной медицине молочная кислота часто применяется в виде кислого молока как депигментирующее средство для удаления пигментаций (веснушки, пигментные пятна, лентиго, хлоазма). 1,0% раствор молочной кислоты применяется в качестве полоскания для рта с целью удаления зубного камня.
Винная. В медицине и фармацевтике для приготовления слабительных и мочегонных средств. В косметической промышленности при воздействии на кожу (в составе косметических средств) винная кислота обладает отшелушивающим, отбеливающим и увлажняющим действием.
Аскорбиновая. Применяется как общеукрепляющее и стимулирующее иммунную систему средство при различных болезнях (простудные, онкологические и т. д.), а также профилактически при недостаточном поступлении с пищей, например, в зимне-весенний период. Аскорбиновая кислота вводится также при отравлении угарным газом, метгемоглобинобразователями в больших дозах — до 0,25 мл/кг 5 % раствора в сутки. Препарат является мощным антиоксидантом, нормализует окислительно-восстановительные процессы.
Ацетилсалициловая. Кислота имеет широкое применение в качестве противовоспалительного, жаропонижающего и анальгезирующего средства. Применяют её самостоятельно и в сочетании с другими лекарственными средствами. Существует целый ряд готовых лекарственных средств, содержащих ацетилсалициловую кислоту (таблетки «Цитрамон», «Кофицил», «Асфен», «Аскофен», «Ацелизин» и др.). В последнее время получены инъекционные препараты, основным действующим началом которых является ацетилсалициловая кислота (см. Ацелизин, Аспизоль). Широко распространено применение аспирина в быту, как средство снять похмелье.
Борная. В медицине — как самостоятельное дезинфицирующее средство. Также на основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например, паста Теймурова.
Аминоуксусная. Глицин оказывает седативное (успокаивающее), мягкое транквилизирующее (противотревожное) и слабое антидепрессивное действие, уменьшает чувство тревоги, страха, психоэмоционального напряжения, усиливает действие противосудорожных препаратов, антидепрессантов, антипсихотиков, уменьшает проявления алкогольной и опиатной абстиненции. Обладает некоторыми ноотропными свойствами, улучшаетпамять и ассоциативные процессы.
Фолиевая (витамин В9). Основная функция фолиевой кислоты и её производных — перенос одноуглеродных групп. Фолиевую кислоту прописывают беременным женщинам. Это хорошие противосудорожные препараты. В злокачественных опухолях, как и в остальных зонах быстрого деления клеток, фолиевая кислота особенно необходима.
Фосфорная. При разведении норок такую кислоту применяют в качестве профилактического средства мочекаменной болезни, в виде водного раствора. Нашлось применение и в такой сфере, как стоматология. Ее применяют для снятия эмали с зубов перед их пломбированием.
Салициловая. Обладает сильными антисептическими и дезинфицирующими свойствами. Применяется в химико-фармацевтической, парфюмерной промышленности, а также в медицине.
III. Задание для внеаудиторной самостоятельной работы:
Выучить конспект.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Основная литература:
Габриелян, О. С. Химия: 11-й класс: базовый уровень: учебник / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — 5-е изд., стер. — Москва: Просвещение, 2023. — 128 с.
Урок 19. Кислоты. - Химия - 11 класс – Видео. // Российская электронная школа: сайт. – URL: https://resh.edu.ru/subject/lesson/2055/main/ (дата обращения: 12.04.2024).
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
ПРИЛОЖЕНИЕ А
Физкультминутка для глаз
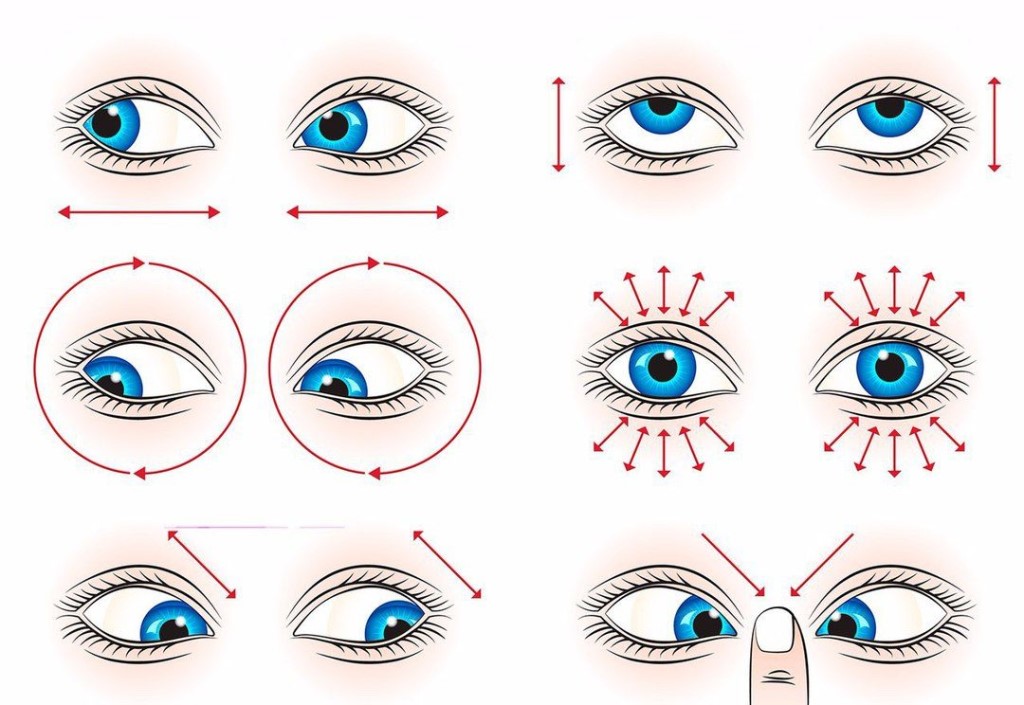








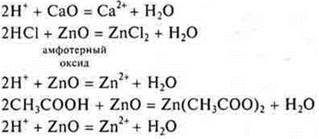
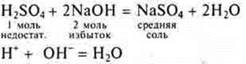


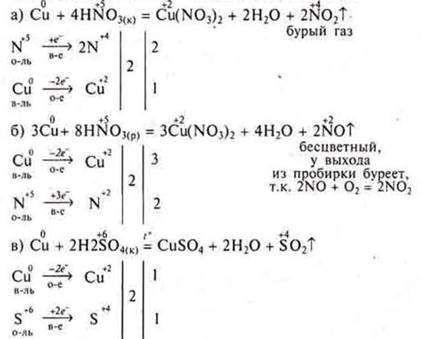

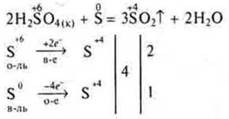
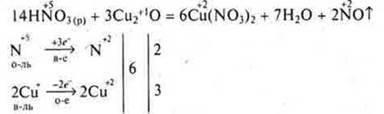
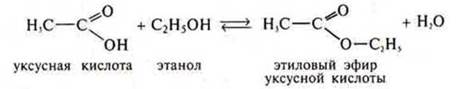


 — метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.
— метановая (муравьиная) кислота — альдегидокислота. Она дает реакцию «серебряного зеркала», выступает восстановителем.
 - молочная кислота, также обладает двойственными свойствами — это спиртокислота.
- молочная кислота, также обладает двойственными свойствами — это спиртокислота.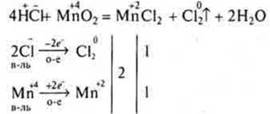
 — восстановитель, взаимодействуя с Ag2O(NH3 · Н2O);
— восстановитель, взаимодействуя с Ag2O(NH3 · Н2O); — окислитель, взаимодействуя с металлами.
— окислитель, взаимодействуя с металлами. , состоящие из атомов
, состоящие из атомов  NaNO3
NaNO3










