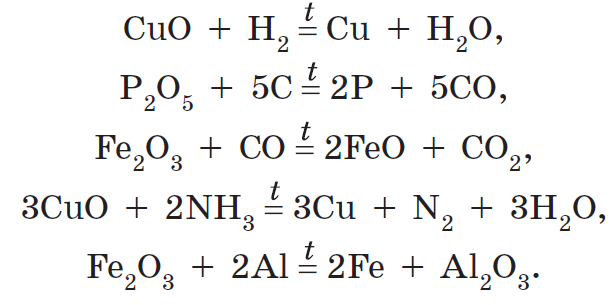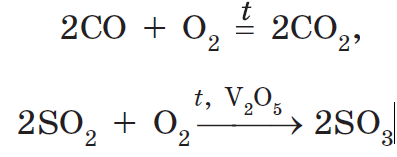Кислород — самый распространённый элемент на Земле, более того, кислород — очень реакционноспособный элемент, поэтому он входит в состав самых разнообразных соединений: природных ископаемых, воды, в состав биологически важных веществ. Поэтому классификацию неорганических соединений традиционно начинают с рассмотрения соединений элементов с кислородом, а именно с оксидов.
ОКСИДЫ
Оксидами называют сложные вещества, состоящие из двух элементов, один из которых — кислород в степени окисления —2.
Кислородные соединения химических элементов можно классифицировать по типу химических связей, по способности образовывать соли и по кислотно-основным свойствам.



ВАЖНО .ЗНАТЬ!
к К оксидам не могут быть
отнесены такие соединения, как, например, H2O2, Na2O2 (пероксид, содержащий ион O22-), KO2 (надпероксид, содержащий ион О2-) или KO3 (озонид, содержащий ион О3-).
Оксиды с ионным типом связи в твёрдом состоянии образуют ионные кристаллические решётки. Для них, как правило, характерны высокие температуры плавления, они не электропроводны в твёрдом состоянии, но проводят электрический ток в расплавах и в растворах.
Диоксид кремния SiO₂ (кварц) — вещество с ковалентными связями, образует атомную кристаллическую решётку с высокой температурой плавления. Высший оксид азота N₂0₅ образует ионную кристаллическую решётку.
Оксиды с ковалентным типом связи в твёрдом состоянии образуют молекулярные кристаллические решётки. Это вещества с низкими или невысокими температурами плавления и кипения, не способные проводить электрический ток ни в твёрдом, ни в жидком состоянии. Они могут представлять собой газы (SO2, NO2), жидкости (H2O, SO3, Mn2O7) или легколетучие твёрдые вещества (P2O5).
В зависимости от природы элементов, входящих в состав оксида, связь может изменяться от ионной (оксиды щелочных и щелочноземельных металлов, например Na
2O, CaO) до ковалентной (оксиды неметаллов и переходных металлов в высших степенях окисления, например CO
2, P
2O
5, Mn
2O
7).
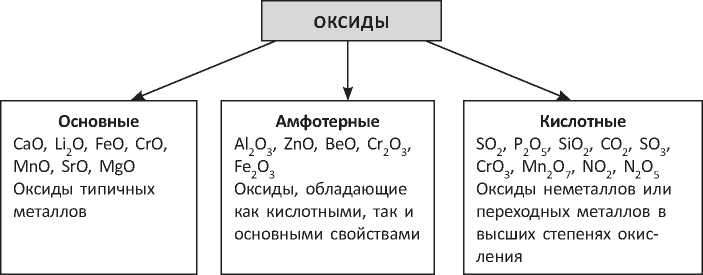
По способности оксидов образовывать соли их делят на солеобразующие и несолеобразующие (например, NO, N2O и СО). Солеобразующие оксиды подразделяют на основные, амфотерные и кислотные (схема 7.1)
Увеличение степени окисления элемента в оксиде приводит к ослаблению проявляемых им основных свойств и усилению кислотных. Так, оксид хрома(П) CrO является основным оксидом, оксид хрома(Ш) Cr2O3 амфотерен, а оксид хрома в высшей степени окисления +6 CrO3 — кислотный оксид.
Общие методы получения оксидов
Окисление простых и сложных веществ кислородом:
2Са + O2 = 2CaO,
 4Р + 5O2= 2Р2O5,
4Р + 5O2= 2Р2O5,
2ZnS + 3О2 = 2ZnO + 2SO2 (обжиг сульфидов металлов),
2СО + O2 = 2СО2.
Метод окисления простых и сложных веществ кислородом практически неприменим для щелочных металлов (за исключением лития), которые при окислении обычно дают пероксиды и надпероксиды
Разложение оснований, кислородсодержащих кислот и солей при нагревании:
Zn(OH)2 = ZnO + H2O,
H2SiO3 X SiO2 + H2O,
2Cu(NO3)2 = 2CuO + -INO2 + O2.
Кроме общих методов получения оксидов, для кислотных оксидов существует способ, основанный на получении кислоты, соответствующей этому оксиду, и дальнейшем её обезвоживании. В качестве водоотнимающего средства наиболее часто используются концентрированная серная кислота и оксид фосфора ):
K2Cr2O7 + H2SO4(конц) = 2CrO3Ф + K2SO4 + H2O,
2HNO3(конц) + P2O5 = N2O5 + 2HPO3.
Основные оксиды. Поскольку большинство основных оксидов представляет собой твёрдые кристаллические вещества с ионным типом связи, они обладают высокими температурами плавления и кипения и не разлагаются при нагревании. Исключение составляют оксиды ртути и серебра, легко разлагающиеся на простые вещества:
2HgO = 2Hg + O2,
2Аg₂O = 4 Ag + O2.
Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, а также с кислотами с образованием солей:
 CaO + CO2 = CaCO3,
CaO + CO2 = CaCO3,
MgO + Al2O3 = Mg(AlO2)2,
ZnO + H2SO4 = ZnSO4 + H2O.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием соответствующих оснований:
Li2O + H2O = 2LiOH,
BaO + H2O = Ba(OH)2.
Остальные оксиды из-за нерастворимости соответствующих оснований не реагируют с водой.
Кислотные оксиды. Большинство кислотных оксидов могут взаимодействовать с водой с образованием кислот (именно поэтому они называются ангидридами соответствующих кислот):
SO3 + H2O = H2SO4,
P2O5 + H2O = 2HPO3,
P2O5 + BH2O = 2H3PO4,
N2O5 + H2O = 2HNO3.
Кислотные оксиды реагируют с сильными основаниями (щелочами):
Ca(OH)2 + SO2 = CaSO3 + H2O
и взаимодействуют с основными и амфотерными оксидами:
SO₃ + CaO = CaSO₄,
P₂O₅ + Al₂O₃ = 2AlPO₄
Амфотерные оксиды могут вступать в реакции, характерные как для основных, так и для кислотных оксидов. Амфотерные оксиды не растворяются в воде. К амфотерным оксидам относят оксид алюминия Al2O3, оксид хрома(Ш) Cr2O3, оксид бериллия BeO, оксид цинка ZnO, оксид железа(Ш) Fe2O3 и некоторые другие.
Al2O3 + 6HCl = 2AlCl3 + 3H2O,
Al2O3 + 2NaOH + 3H2O __ 2Na[Al(OH)4].
Амфотерный оксид железа(Ш) не растворяется в разбавленных щелочах (соответствующий гидроксокомплекс не образуется).
Почти все оксиды участвуют в реакциях восстановления до простых веществ или до оксида, в котором элемент проявляет меньшую степень окисления. Типичными восстановителями в подобных реакциях могут выступать водород, углерод, оксид углерода(П), аммиак, алюминий. Эти реакции протекают при нагревании:
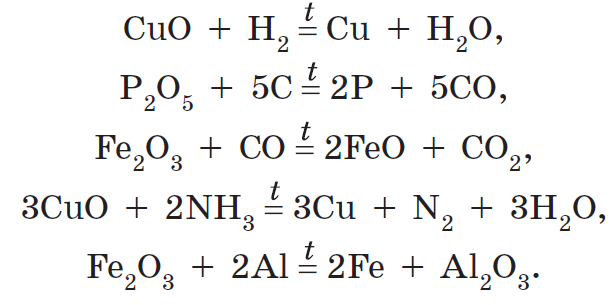
Оксиды, образованные элементами в промежуточных степенях окисления, могут участвовать в реакциях окисления, повышая степень окисления элемента. Иногда для этого достаточно кислорода воздуха:
2NO + O2 = 2 NO2,
4FeO + O2 = 2Fe2O3,
в других случаях требуются специальные условия (нагревание, катализатор):
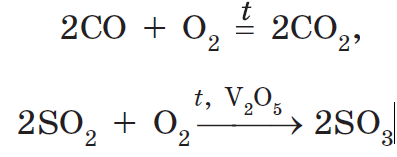










 4Р + 5O2= 2Р2O5,
4Р + 5O2= 2Р2O5,