Дата:
Класс: 11
Учитель:
Предмет: Химия
Тема: «Скорость химической реакции. Катализ».
Задачи урока:
Обучающие:
- актуализировать знания о скорости химических реакций и факторах, влияющих на нее;
дать понятие о механизме действия катализаторов;
расширить знания о катализе, катализаторах, ферментах;
показать практическую значимость изучаемого материала.
Развивающие:
- развивать умение самостоятельно работать с текстом учебника;
- развивать умение поиска информации в ресурсах Интернета;
- совершенствовать умение работать с разного вида информацией.
Воспитательные:
- формировать активную и сознательную позицию к усвоению нового материала;
развивать любознательность;
совершенствовать навыки самоорганизации труда и самообразования.
Тип урока: урок - изучение нового материала.
Метод проведения: частично - поисковый, информационный, с применением демонстрационных и лабораторных опытов.
Формы работы:
Фронтальная, работа в парах и группах.
Межпредметные связи:
Биология (белки – ферменты)
Требования программы:
знать: понятия «катализ», «катализаторы», «ферменты» и особенности их функционирования;
уметь: определять зависимость скорости химических реакций от различных факторов.
Ход урока.
1. Оргмомент.
Здравствуйте, ребята! Садитесь. Начинаем урок.
На доске написаны слова русского философа, филолога, историка культуры Михаила Михайловича Бахтина. Прочитайте их. (Один ученик читает вслух.)
Истина не рождается в голове отдельного человека,
она рождается между людьми, совместно
ищущими истину в процессе их диалогического общения.
М.М.Бахтин
Поэтому мне хотелось бы, чтобы мы сегодня вместе думали, рассуждали, высказывали свое мнение.
2. Актуализация знаний.
Фронтальный опрос:
(повторение изученного на прошлом уроке)
По каким признакам классифицируют химические реакции?
По признаку обратимости какими бывают реакции? (обратимые, необратимые)
По степени изменения степени окисления? (ОВР, неОВР)
В зависимости от присутствия катализатора?
3. Новый материал.
Приступим к изучению новой темы как раз-таки связана с классификацией химических реакций в зависимости от присутствия катализатора.
Запишите в тетрадях число и тему урока - «Скорость химической реакции. Катализатор».
Как вы думаете, что на уроке сегодня мы узнаем новое? Чему научимся?
Итак, задачи урока: расширить знания о катализе, катализаторах, ферментах, рассмотреть механизм действия катализаторов; провести исследование действия разных катализаторов на одно и то же вещество – перекись водорода.
3.1. Понятия « скорость химической реакции» «катализ», «катализатор», «каталитические реакции»
Скорость химической реакции — отношение изменения концентрации реагента ко времени, за которое это изменение произошло.
Катализ является одним из наиболее распространённых в химической практике методов ускорения химических реакций. Первые научные сведения о нем относятся к началу 19 в. В 1806 французские химики Н. Клеман и Ш. Дезорм открыли каталитическое действие оксидов азота на окисление сернистого газа в процессе получения серной кислоты. (На доске уравнение реакции, фамилии ученых) За этим последовало открытие и ряда других примеров резкого положительного действия веществ на скорость или возникновение химических реакций. В 2007г немецкому ученому Герхарду Эртлю (Gerhard Ert), который исследовал химические процессы на твердых поверхностях и внес значительный вклад в понимание природы катализа была присуждена Нобелевская премия по химии.
Демонстрация 1. (Al + I2)
Рассмотрим такой пример. В пробирке и ступке находится смесь порошков иода и алюминия.
Охарактеризуйте, пользуясь таблицей Менделеева и рядом напряжений металлов, их химическую активность. (Алюминий – достаточно активный металл, иод – галоген, для завершения слоя которому необходим всего один электрон.)
Запишите на доске и в тетрадях уравнение реакции их взаимодействия.
(На доске ученик записывает уравнение)
Однако, сейчас мы не наблюдаем никаких признаков реакции. Добавлю капельку воды. Мы наблюдаем возгонку иода. Алюминий в присутствии воды стал взаимодействовать с иодом, эта реакция сопровождается большим выделением тепла, что приводит к испарению части иода.
Сейчас мы с вами наблюдали изменение скорости взаимодействия алюминия и иода в присутствии воды. Подобные явления носят название «катализ».
Запишем в тетрадях определение катализа.
Катализ – изменение скорости химической реакции в присутствии веществ - катализаторов, которые участвуют в реакции, но не входят в состав продуктов.
Вода в данной реакции играет роль катализатора, изменяющего скорость реакции.
Найдите в учебнике определение термина «катализатор», прочитайте его. Сравните с термином, который нам ранее был известен. Какое есть отличие в формулировке?
Это название произошло от лат. «katа1уsis» - разрушение, разложение. С помощью катализатора происходит как бы разрушение длинного пути, который предстояло пройти исходным веществам, пока они не превратятся в продукты реакции.
Закройте учебники. Пользуясь определением «катализа», дайте свое определение «катализатора». Запомните его.
Катализатор – вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Более 70% всех химических превращений веществ, а среди новых производств более 90% осуществляется с помощью катализаторов.
Как в уравнении реакции обозначается катализатор?
Все реакции по наличию катализатора делятся на 2 группы. Обсудите в парах и закончите схему на основе имеющихся у вас знаний.
Реакции (по наличию катализатора)

(Каталитические– (Некаталитические–
реакции с участием катализаторов) реакции без участия катализаторов)
(Один учащийся отвечает)
3.2. Виды катализа.
Катализаторы оказывают различное влияние на скорость химических реакций: одни ускоряют, другие ее замедляют. Рассмотрим классификацию катализа.


Автокатализ – катализаторами являются продукты реакции.
Положительный – скорость реакции при добавлении катализатора возрастает
Отрицательный - скорость реакции при добавлении катализатора уменьшается

Катализ (по направленности процесса)
Как вы думаете, что обозначает каждый термин?
Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, - ингибиторами.
Ингибитор – вещество, замедляющее скорость химической реакции, но состав и количество которого в конце реакции остаётся неизменным. Лат. «inhibere» - удерживать.
Какой катализ мы рассмотрели на примере взаимодействия алюминия с иодом? (положительный)
Какие вы можете назвать примеры отрицательных катализаторов?
(антиокислители, антистарители, ингибиторы коррозии)
Кроме того, есть еще одна классификация катализа.
Прочитайте текст учебника и закончите схему (с. 136-137)
К
 атализ (по фазовому составу исходных веществ и катализатора)
атализ (по фазовому составу исходных веществ и катализатора)
Гомогенный – катализ, при котором катализатор и реагирующие вещества находятся в одной фазе.
Гетерогенный – катализ, при котором реагирующие вещества и катализатор находятся в разных фазах
При гетерогенном катализе обычно катализатор - твердое вещество, а реагирующие вещества - газы или жидкости. Все реакции при гетерогенном катализе протекают на поверхности катализатора.
Зная другие факторы, влияющие на скорость реакции, предложите способ увеличения скорости гетерогенно-каталитического процесса с твердым катализатором, обоснуйте его.
(Необходимо катализатор измельчить, что увеличит поверхность соприкосновения, а значит, и скорость.)
Такой метод широко используется в промышленности и носит название «кипящего слоя».
Демонстрация 2.
Рассмотрим еще одну химическую реакцию.
В две пробирки помещаем перманганат калия, щавелевую кислоту, серную кислоту, всё перемешиваем. В один цилиндр помещаем в качестве катализатора сульфат марганца, перемешиваем.
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 (MnSO4) → 2 MnSO4 + K2SO4 + 10 CO2 + 8 H2O
Какие выводы мы можем сделать по результатам данного опыта?
(Реакция в присутствии катализатора сульфата марганца идет намного быстрее. Данная реакция – пример гомогенного катализа.)
На доске и в раздаточном материале у вас на столах в задании 1 записаны 3 уравнения реакций. Определите вид катализа по уравнению. Работа в группе (1 мин).
NO
2SO2 + O2 → 2SO3 (гомогенный – все газы)
Cr2O3
4 NH3 + 5 O2 → 4 NO + 6 H2O (гетерогенный – оксид хрома твердый)
СuO + 2HCl = Cu Cl2 + H2O (некаталитическая реакция)
3.3. Свойства катализаторов.
Катализаторы обладают определёнными свойствами. Одно из них – избирательность действия. Избирательность – это действие катализатора на определенную химическую реакцию.
Прочитайте задание 2. Рассмотрите уравнения реакций. Укажите, как человек использует знания о избирательности катализаторов. Время на работу в группе – 1мин.
(применяя разные катализаторы, можно получить из одного и того же вещества разные продукты.)
3.4. Механизм действия
Давайте вспомним, что мы называем катализатором?
Каким образом катализатор влияет на скорость реакции? Рассмотрим механизм действия катализатора на примере гомогенного катализа.
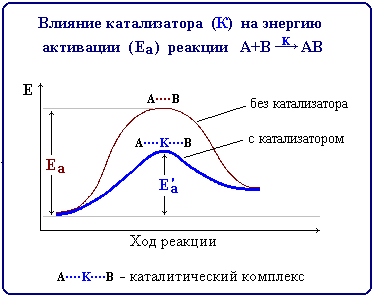
Сейчас мы обратимся к графику в 3 задании. Внимательно рассмотрите график. Вспомните, что называется энергией активации. Какие характеристики показаны на осях? Расскажите по графику о влиянии катализатора на протекание реакции. (Время для работы в группе – 2 минуты)
(Катализатор увеличивает скорость реакции за счет того, что снижает энергию активации.)
За счет чего именно идет снижение Е активации? Рассмотрим опыт.
Демонстрация 3.
В химическую колбу наливаю пероксид водорода.
Почему перекись водорода нужно хранить в прохладном темном месте?
(нагревание и освещение ускоряют разложение перекиси)
Запишите уравнение реакции разложения пероксида водорода.
(1 пишет на доске)
Добавляю дихромат калия – катализатор, ускоряющий разложение перекиси.
Ребята, не противоречит ли увиденное нами изменение цвета раствора дихромата калия тому, что катализатор остается неизменным?
K2Cr2O7 + H2O2 → K2[Cr2O7 * H2O2] – промежуточное соединение
K2[Cr2O7 * H2O2] + H2O2 → K2Cr2O7 + 2 H2O + O2
Данный опыт пожтверждает теорию промежуточных соединений для объяснения механизма действия катализаторов. Согласно этой теории, катализатор вступает в реакцию с исходным веществом с образованием промежуточного продукта. Но к концу реакции катализатор восстанавливается в исходном состоянии.
4. Подведение итогов.
Наш урок, ребята подходит к концу. Давайте подведем его итоги.
Что нового вы сегодня узнали на уроке?
Где на практике мы можем использовать знания по теме сегодняшнего урока?
Какие виды работ на уроке вам сегодня запомнились?
Оценки за урок.
5. Домашнее задание.
Учебник О.С. Габриеляна – 135-139с., №6,7 с.140