
Тема урока: Решение задач с использованием химического уравнения, если одно из веществ дано в избытке

Алгоритм расчетов по химическим уравнениям, если одно из реагирующих веществ дано в избытке:
- Записать условие и вопрос задачи (дано, найти).
- Записать уравнение реакции (исходные вещества, продукты, расставить коэффициенты).
- Найти количества исходных веществ.
- Определить избыточный и недостаточный реагенты.
- Рассчитать искомое вещество по реагенту, находящемуся в недостатке.
- Правильно записать ответ.

Пример решения задачи
Смешали два раствора, содержащих соответственно 33,3 г хлорида кальция и 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.

Запишем условие задачи:
Дано: Решение:
m ( CaCl 2 )=33,3 г
m ( Na 3 PO 4 )=16,4 г
Найти:
m(Ca 3 (PO 4 ) 2 )- ?

1) Запишем уравнение реакции, расставим коэффициенты:
3 CaCl 2 + 2Na 3 PO 4 = Ca 3 (PO 4 ) 2 ↓ + 6NaCl
2) Найдем количества веществ, масса которых дана в условии задачи:
M ( CaCl 2 )= 1*40 + 2*35,5 = 111 г/моль
M ( Na 3 PO 4 )= 3*23 + 1*31 + 4*16 = 164 г/моль

3) Над формулами веществ запишем данные о количестве веществ, найденных из условия задачи, а под формулами – стехиометрические соотношения, отображаемые уравнением реакций
0,3 моль 0,1 моль х моль 3 CaCl 2 + 2 Na 3 PO 4 = Ca 3 ( PO 4 ) 2 ↓ + 6 NaCl 3 моль 2 моль 1 моль

4) Определим, какой из реагентов взят в избытке. Для этого составим пропорцию соотношений количеств реагирующих веществ по условию и уравнению реакций:
0,1 ˃ 0,05, значит
CaCl 2 – в избытке, Na 3 PO 4 – в недостатке. Расчет ведем по Na 3 PO 4 .

5) Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию:
n(Ca 3 (PO 4 ) 2 ) = 0,05 моль
6 ) Найдем массу вещества, которую требуется вычислить: m = n * M
M ( Ca 3 ( PO 4 ) 2 )= 3*40 + 2*31 + 8*16 = 310 г/моль m ( Ca 3 ( PO 4 ) 2 )= 0,05 моль * 310 г/моль = 15,5 г
7) Запишем ответ: Ответ: m ( Ca 3 ( PO 4 ) 2 )= 15,5 г

Решение задач
№ 2-59. Вычислите массу соли, образовавшейся при взаимодействии азотной кислоты массой 6,3 г с раствором, содержащим гидроксид натрия массой 2 г.
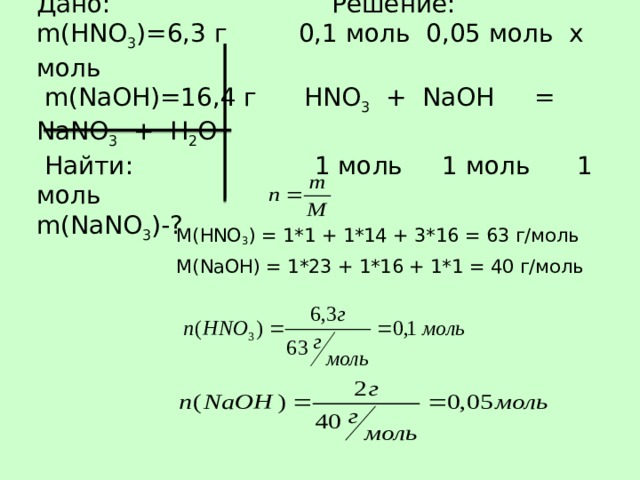
Дано: Решение: m ( HNO 3 )= 6 ,3 г 0,1 моль 0,05 моль х моль m ( NaOH )=16,4 г HNO 3 + NaOH = NaNO 3 + H 2 O Найти: 1 моль 1 моль 1 моль m(NaNO 3 )- ?
M ( HNO 3 ) = 1*1 + 1*14 + 3*16 = 63 г/моль
M ( NaOH ) = 1*23 + 1*16 + 1*1 = 40 г/моль

0,1 ˃ 0,05, значит HNO 3 – в избытке, NaOH – в недостатке. Расчет ведем по NaOH .
n(NaNO 3 ) = 0,05 моль
m = n * M
M ( NaNO 3 ) = 1*23 + 1*14 + 3*16 = 85 г/моль
m ( NaNO 3 ) = 0,05 моль * 85 г/моль = 4,25 г
Ответ: m ( NaNO 3 ) = 4,25 г

Решение задач
№ 2-63. Вычислите массу соли, образовавшейся при взаимодействии серной кислоты массой 9,8 г с раствором, содержащим гидроксид кальция массой 14,8 г.

Дано: Решение: m ( H 2 SO 4 )= 9 , 8 г 0,1 моль 0,2 моль х моль m ( Ca ( OH ) 2 )=1 4 , 8 г H 2 SO 4 + Ca(OH) 2 = CaSO 4 + 2H 2 O Найти: 1 моль 1 моль 1 моль m(CaSO 4 )- ?
M ( H 2 SO 4 ) = 2 *1 + 1* 32 + 4 *16 = 98 г/моль
M ( Ca ( OH ) 2 ) = 1*40 + 2*16 + 2*1 = 74 г/моль

0,1 ˂ 0,2 , значит H 2 SO 4 – в недостатке,
Ca ( OH ) 2 – в избытке.
Расчет ведем по H 2 SO 4 .
n(CaSO 4 ) = 0,1 моль
m = n * M
M ( CaSO 4 ) = 1*40 + 1*32 + 4*16 = 136 г/моль
m ( CaSO 4 ) = 0,1 моль * 136 г/моль = 13,6 г

Домашнее задание:
Решить задачи №2-55, 2-58, 2-65.

Спасибо за внимание!!!

































