Просмотр содержимого документа
«Презентация к уроку физики на тему "Строение атома"»


Немного истории
- Демокрит: существует предел деления атома.
- Аристотель: делимость вещества бесконечна.
- Париж, 1626 г.: учение об атоме запрещено под страхом смерти.
- Сторонниками атомистической теории были М.В. Ломоносов, Ж. Гей-Люссак, Д. Дальтон и др.

Толчком к подробному изучению строения атома послужили:
- открытие рентгеновского излучения (1895 г., В.К. Рентген);
- открытие радиоактивности и новых радиоактивных элементов (1896 г., А. Беккерель, М. и П. Кюри);
- открытие электрона (1896 г., Дж. Дж. Томсоном)
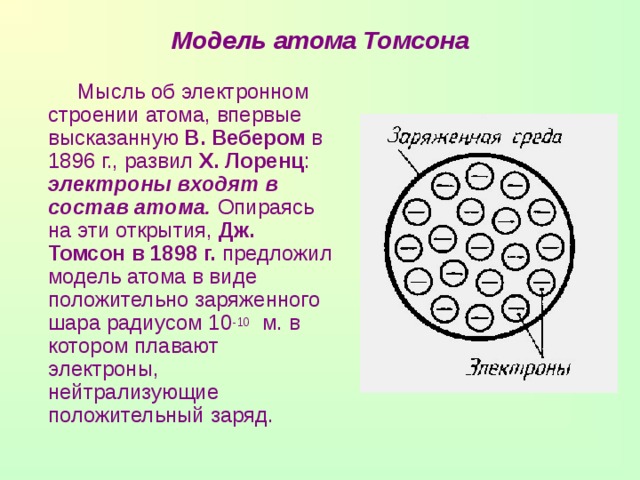
Модель атома Томсона
Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил X. Лоренц : электроны входят в состав атома. Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м. в котором плавают электроны, нейтрализующие положительный заряд.

Ядерная модель атома
- Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом.
- Идея опыта заключалась в изучении рассеяния -частиц (заряд +2е, масса 6,64 * 10 -27 кг) на атомах. -частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов ( -лучи) и, в отличие от -лучей они имеют электрический заряд.
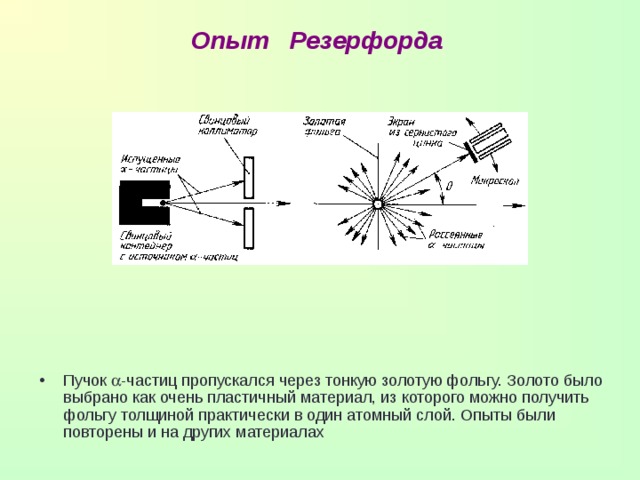
Опыт Резерфорда
- Пучок -частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Опыты были повторены и на других материалах

Выводы из опыта Резерфорда
Э. Резерфорд и его помощники обнаружили, что какая-то часть -частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть отражается от фольги.
Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
- Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома ( 10 -15 м).
- В ядре сконцентрирована почти вся масса атома.
- Отрицательный заряд всех электронов распределен по всему объему атома и компенсирует положительный заряд ядра.

Недостатки планетарной модели
Предложенная модель строения атома не позволила объяснить устойчивость атома:
- ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10 -8 с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами;
- спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым;
- нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются?

ПОСТУЛАТЫ БОРА
1. Атомная система может находиться только в особых стационарных квантовых состояниях, каждому из которых соответствует определенная энергия Е n .
В стационарном состоянии атом не излучает.
2. При переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En излучается квант энергии:


Правило квантования орбит:
- Электроны могут двигаться в атоме только по определённым орбитам, которые определяются условием:
- где r n - радиус n -ой орбиты; v n - скорость электрона на этой орбите; m e - масса электрона, п - целое число - номер орбиты или главное квантовое число.

- Выражение для радиусов разрешённых орбит:

Квантованные значения радиусов орбит:

Постулаты Бора объясняют происхождение линейчатых спектров и их закономерности


По второму постулату Бора возможные частоты излучения водорода равны:
где R – постоянная Ридберга, равна 3,2*10 15 с -1 ;
n и k – номера орбит.

Видимый свет
И. Бальмер (1885г.)
П = 3 , 4, 5 и т.д., R= 3,2*10 15 Гц

Ультрафиолетовая серия
Т. Лайман
п= 2, 3, 4, 5 и т.д.

Инфракрасная серия
Ф. Пашен
п= 4, 5 и т.д.

Трудности теории Бора
- Правило квантования Бора применимо не всегда, представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось условным. Теория Бора неприменима для многоэлектронных атомов и не объясняет ряд спектральных закономерностей.
- В 1917 г. А. Эйнштейн предсказал возможность перехода атома с высшего энергетического состояния в низшее под влиянием внешнего воздействия. Такое излучение называется вынужденным излучением и лежит в основе работы лазеров .




































