Тема «Водород»
В ходе изучения темы «Водород» обучающиеся должны приобрести следующие:
знания: строение, свойства и способы получения водорода; умения: наблюдать, анализировать, сравнивать, обобщать, делать выводы; результаты: - личностные: формирование: ответственного отношения к учению, готовности и способности к саморазвитию и самообразованию на основе мотивации к обучению и познанию; устойчивых познавательных интересов; уважительного отношения к труду; осознанного, уважительного и доброжелательного отношения к другому человеку, его мнению; - метапредметные: умение соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, делать выводы; владение основами самоконтроля, самооценки, принятия решений и осуществления осознанного выбора в учебной и познавательной деятельности; умение преобразовывать знаки и символы для решения познавательных задач; смысловое чтение; умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками, работать индивидуально и в группе, находить общее решение; - предметные: овладение основами химической грамотности, способностью анализировать и объективно оценивать; наблюдения за превращениями веществ при проведении несложных химических экспериментов с использованием лабораторного оборудования и приборов; формирование представлений о значении химической науки в решении современных экологических проблем, в том числе в предотвращении техногенных и экологических катастроф.
Калюжная В.В.
Учитель химии МБОУ «Советская СШ № 1»
Химия 8 класс Урок № 29 Дата ____________
Тема: Свойства и применения водорода
Лабораторная работа № 6 Взаимодействие водорода с оксидом меди (II)
Тип урока: урок усвоения новых знаний.
Метод обучения: обучение в сотрудничестве.
Цель урока: организовать деятельность учащихся по изучению физических и химических свойств, описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного эксперимента.
Задачи:
Образовательные: рассмотреть химические свойства водорода, его способность взаимодействовать с металлами, неметаллами, кислородом, оксидами металлов; научиться обнаруживать водород; совершенствовать знания о типах химических реакций – соединения и замещения; формировать умение предсказывать продукты реакций; познакомиться с новым видом бинарных соединений - гидриды; знать области применения водорода.
Развивающие: развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к само- и взаимоконтролю.
Воспитательные: продолжить формирование научного мировоззрения учащихся, воспитывать культуру общения через работу в парах «ученик – ученик», «учитель – ученик», а также наблюдательность, внимание, пытливость, инициативу.
Оборудование: компьютер, презентация « Свойства и применение водорода», видео «Заполнение водородом мыльных пузырей», проектор, интерактивная доска.
Реактивы: цинк (гранулы), раствор соляной кислоты, оксид меди (II) (порошок), штатив, спиртовка.
ХОД УРОКА
Организационный этап (1 мин.) СЛАЙД 1
Здравствуйте ребята!
Для работы на уроке вам потребуется: учебник, тетрадь, ручка, Периодическая система Д.И. Менделеева, а так же ваше желание получить новые знания!
Орешек знаний твёрд,
но всё же, мы не привыкли отступать,
нам расколоть его поможет
наш девиз: «Хотим всё знать!»
Готовы, тогда начнем!
2. Этап подготовки учащихся к активной познавательной деятельности ( 3 мин.)
СЛАЙД2. Вот какая история произошла с французским химиком, директором Парижского музея науки Пилатром де Розьером(1756–1785). Как-то он решил проверить, что будет, если вдохнуть газ; полученный в результате взаимодействия кислоты и металла. Не заметив никакого эффекта, ученый решил убедиться, проник ли газ в легкие. Он еще раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако вещество в легких экспериментатора смешался с воздухом, и произошел сильный взрыв. «Я думал, что у меня вылетели все зубы вместе с корнями», — так Розье характеризовал испытанные ощущения. Впрочем, он остался очень доволен опытом, который чуть не стоил ему жизни.
Что это за газ и почему произошел взрыв?
Правильно – это водород.
Повторять такой эксперимент мы с вами не будем, а будем соблюдать все правила техники безопасности при работе с химическими веществами.
3.Актуализация знаний для изучения нового учебного материала
Учитель. Хорошо ли вы усвоили материал прошлого урока мы проверим проведя тест (5 мин) СЛАЙД 3 ответы мы заносим в оценочный лист. Тест 1.
Тест. Задание. Необходимо выбрать правильные утверждения, Если вы согласны с утверждением, ставьте напротив цифры плюс, если нет, то минус.
Водород – самый распространённый элемент во Вселенной.
Водород – самый распространённый газ на Земле.
Основным соединением водорода на нашей планете является вода.
Валентность водорода равна 2.
Формула простого вещества водорода равна Н2.
Осуществим взаимопроверку
СЛАЙД 4 ВОПРОСЫ:
1) При помощи каких реакций можно получить водород, к какому типу относятся эти реакции.
2) Какими методами можно собрать водород при получении?
СЛАЙД 5. Подведем итог. Где распространен водород? Водород – самый распространенный химический элемент во Вселенной, является составной частью Солнца и звезд. В организме человека содержится 60% водорода. Входит в состав воды.
Водород получают: Водород можно получить в лаборатории разложением воды, взаимодействием металлов с кислотами, взаимодействием активных металлов с водой.
Собирают водород: методом вытеснения воздуха из пробирки и метод вытеснения воды.
Учитель: Что мы уже знаем о водороде? (нахождение в природе, получение водорода)
Объяснить почему происходит взрыв мы не можем. А чего еще не знаем о водороде? (какими свойствами он обладает водород)
Изучение нового учебного материала.
Учитель: Предложите тему урока.
СЛАЙД 6. Откройте тетради и запишите число и тему урока
«ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
И ЕГО ПРИМЕНЕНИЕ»
Объясните, почему мыльные пузыри, заполненные водородом, поднимаются в вверх. Опыт с мыльными пузырями.
ФИЗИЧЕСКИЕ СВОЙСТВА (5 мин)
Задание. Прочитайте в учебнике о физических свойствах водорода.
Начиная с последней парты первого ряда от окна, назовите по одному физическому свойству водорода.
СЛАЙД 7. Вывод. Водород – самый легкий газ, в 14 раз легче воды. Нерастворим в воде. Имеет очень низкую температуру сжижения.
Учитель. А знаете ли вы, лёгкость Н2 находит широкое применение. Во время войны водородом заполняли аэростаты . Они защищали небо над Москвой от налётов немецкой авиации. Н2 наполняют воздушные шары, на которых поднимают метеорологические приборы. Для исследования атмосферы. Но в последнее время, водород чаще заменяют гелием, хотя он и тяжелее. Почему?
Мы рассмотрели физические свойства, переходим к изучению химических свойств водорода.
ХИМИЧЕСКИЕ СВОЙСТВА (20 мин) СЛАЙД 8
СЛАЙД 9
1.Реакция горения.
При взаимодействии водорода с кислородом образуется вода. Водород без примесей сгорает спокойно.
Горение 2H2 + O2= 2H2O
Однако смесь водорода с кислородом или воздухом взрывается. Наиболее взрывоопасна смесь, состоящая из двух объемов водорода и одного объема кислорода – гремучий газ. Реакция протекает со взрывом.
Не шутите с Водородом!
Он горит , рождая воду,
В смеси с Кислородом- братом
Он взрывается , ребята!
Вам скажу на всякий случай –
Эту смесь зовут « гремучей».
Вывод: прежде чем поджигать водород, необходимо проверить его на чистоту.
СЛАЙДЫ 11-12Учитель. Молекулы водорода довольно прочны. Для того, что бы водород мог вступать в химические реакции, должна быть затрачена большая энергия. Поэтому при комнатной температуре водород реагирует только с очень активными металлами и фтором. Остальные реакции идут при повышенной температуре.
СЛАЙД 12.
Физкультминутка.
Достаточно долго наши мышцы находились в относительной статике (физика – неподвижность). Переходим к физкультминутке. Осанка определяет красоту и здоровье, а подвижность суставов – наше долголетие.
СЛАЙД 13
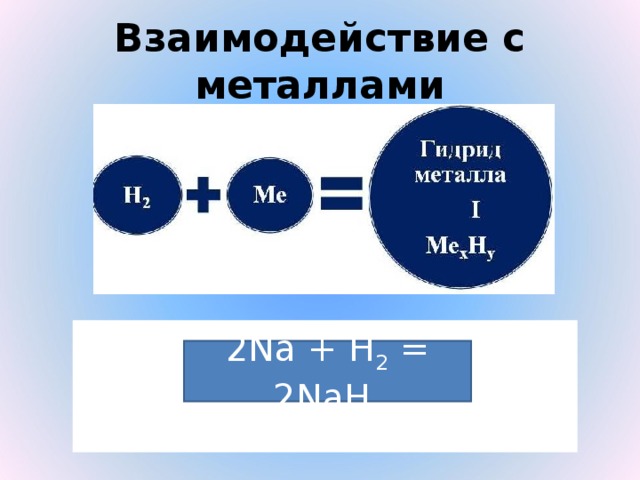
Взаимодействие с активными металлами 2Na + H2 = 2NaH – гидриды
СЛАЙД 14
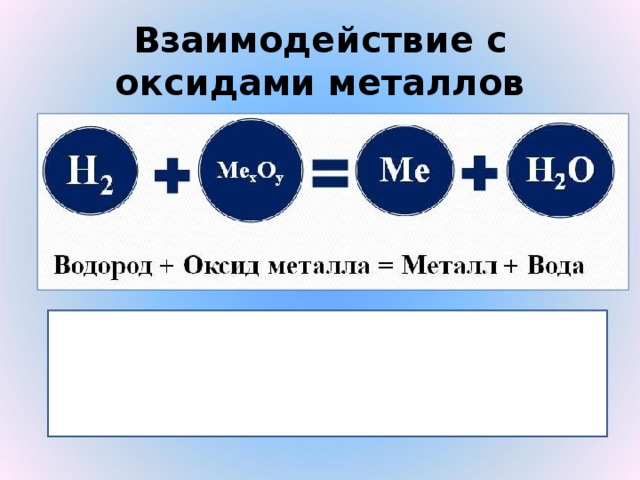
Взаимодействие с оксидами металлов
Для изучения этого свойства водорода мы проведем лабораторный опыт. Работаем в парах.
СЛАЙД 15. Учитель: ЗАПИШЕМ В ТЕТРАДЯХ.
Лабораторная работа № 6
Взаимодействие водорода с оксидом меди.
ТБ перед проведением работы:
- проводить работу при убранных со стола лишних предметов
- внимательно прочитать инструктивную карточку
- прогреть пробирку
- работать осторожно со спиртовкой, держать наготове колпачок.
Ход работы
Откройте учебник на странице 99. Посмотрите на рисунок 38 в учебнике.
Соберите прибор, изображенный на рисунке проверьте его на герметичность.
Залейте цинк в пробирке раствором соляной кислоты ( примерно 1/3 пробирки).
Закройте пробирку газоотводной трубкой. Проверьте водород на чистоту. Поместите конец газоотводной трубки в пробирку с оксидом меди (II). Пробирка с оксидом меди должна быть закреплена немного под наклоном.
Зажгите спиртовку и нагревайте пробирку с оксидом меди (II), перед этим предварительно ее прогрев. Как только заметите, что образовалось вещество красного цвета, прекратите ее нагревание.
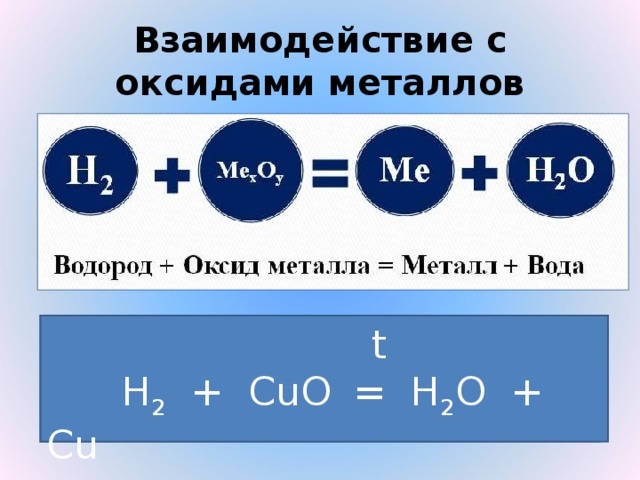
Напишите уравнение реакции:
t
СЛАЙД 16. Н2 + CuO = H2O + Cu
Медь восстанавливается из оксида меди. Водород является восстановителем
СЛАЙД 17. Ответьте на вопросы:
Почему пробирку с оксидом меди (II) закрепили под наклоном?
Почему перед нагреванием оксида меди водород надо проверить на чистоту?
Объясните, почему из черного порошка образовалось вещество красного цвета.
СЛАЙД 18. Вывод: водород взаимодействует с металлами и неметаллами. С металлами он проявляет окислительные свойства, а неметаллами восстановительные. Водород взаимодействует с со сложными веществами – оксидами металлов и восстанавливает металлы из их оксидов. Заполнение таблицы на листах. Вклеить в тетрадь.
Общая схема «Химические свойства водорода»
| С чем реагирует
| Водород | Продукты реакции |
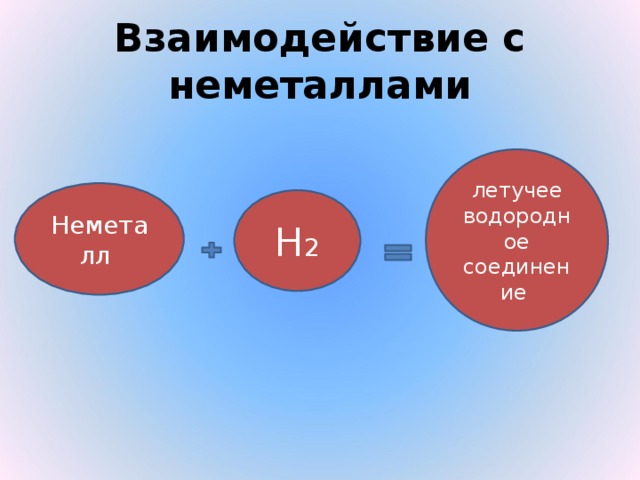
| Неметаллы
| Н2
|
|
| Металлы
| Н2
|
|
| Оксиды металлов
| Н2
|
|
СЛАЙД 19-27
Учитель. Почему водород называют топливом будущего? Где еще применяется водород?
Давайте посмотрим на слайдах, «Применение водорода». Заполняем схему на информационных листах.
Мы рассмотрели на уроке все.
5 Первичное закрепление
СЛАЙД 28. Учитель. Совсем не давно, вы подробно изучали вещество: Бесцветный газ, без вкуса и запаха, тяжелее воздуха, выделяется в процессе фотосинтеза растениями: кислород.
На слайде представлены признаки, характерные для кислорода и водорода.
Задание: выберите признаки, характерные для водорода
1) Газ, поддерживающий горение
2) Легче воздуха
3) В лаборатории получают взаимодействием металлов с кислотами
4) Образует с элементами оксиды
5) Получают из природного газа
6) Образует с металлами соединения - гидриды
7) Тяжелее воздуха
8) Образует с неметаллами летучие водородные соединения
9) Используется как восстановитель в металлургии.
СЛАЙД 29. 3. Закончить уравнения реакций:
I
Cl2 + H2 = HCl
II
Ca + H2 = Ca H
HgO + H2 = _____ + _____
Доп. Зад. Al2O3 + H2 = ____ + ______
WO3 + H2 = _____ + ______
6.Оценивание. СЛАЙД 30
Осуществим взаимопроверку. Выставим оценки за урок.
Подведение итогов урока
Сегодня вы решили проблему, работая вместе, помогая друг другу. Изучили свойства водорода и его применение.
Так и в жизни, для того чтобы решить сложную проблему, нужна взаимопомощь.
Рефлексия СЛАЙД 31
Подумайте и закончите предложения:
– Сегодня на уроке я узнал…
– На уроке я понял…
– Теперь я знаю как…
9.Домашнее задание СЛАЙД 32
п. 29, тестовые задания с. 101
Подготовиться к практической работе № 4 п.29
Подготовить сообщения по темам:
«Водород во Вселенной»,
«Старинные способы получения водорода»,
«Из истории развития воздухоплавания».
СЛАЙД 33. Урок окончен. Спасибо за урок
Al2O3 + H2 = _____ + ______
Al2O3 + H2 = _____ + ______
Al2O3 + H2 = _____ + ______
Al2O3 + H2 = _____ + ______
Al2O3 + H2 = _____ + ______
Al2O3 + H2 = _____ + ______
Al2O3 + H2 = _____ + ______
Общая схема «Химические свойства водорода»
| С чем реагирует
| Водород | Продукты реакции |
| Неметаллы
| Н2
|
|
| Металлы
| Н2
|
|
| Оксиды металлов
| Н2
|
|
Применение водорода











10