В 1 Вариант1
При окислении альдегида массой 8.8 г, содержащего одну альдегидную группу, избытком аммиачного раствора оксида серебра (I) образовалось серебро массой 43,2 г. рассчитайте массу (г) полученной одноосновной кислоты.
Решение:
Общая формула альдегида СnH2nO. Молярная масса 14n + 16 г/моль
Оксид серебра (I) Ag2O.
Серебро Ag. Молярная масса = 108 г/моль. Если масса по условию задачи = 43,2 г, то это составляет 0,4 моль
Общая формула карбоновых одноосновных кислот СnH2nO2. Молярная масса = 14n +32
Составим уравнение реакции: СnH2nO + Ag2O = СnH2nO2 + 2 Ag
14n + 16 2 моль
8,8 0,4
n = 2
Альдегид – С2H4O этаналь М = 44 г/моль
Кислота – С2H4O2 этановая (уксусная) М = 60 г/моль
СnH2nO + Ag2O = СnH2nO2 + 2 Ag
44 60
8,8 Х = 12 г
Записываем ответ:
В 2 Вариант 1
Массовая доля триглицерида, образованного остатками пальмитиновой и стеариновой кислот в мольном отношении 1:2, в некотором жире составляет 21%. Чему равна общая масса (кг) пальмитата и стеарата натрия, полученных в результате омыления данного жира массой 560 кг (выход считать 100%)? (Считайте, что все остатки пальмитиновой и стеариновой кислот входят в состав указанного триглицерида.)
Решение:
Масса триглицерида равна 560.0,21 = 117,6 кг
![]() Формула триглицерида, содержащий 1 остаток пальмитиновой кислоты и 2 остатка стеариновой кислоты : СН2 - О-СО – С15Н31
Формула триглицерида, содержащий 1 остаток пальмитиновой кислоты и 2 остатка стеариновой кислоты : СН2 - О-СО – С15Н31
![]() СН - О-СО – С17Н35
СН - О-СО – С17Н35
СН2 - О-СО – С17Н35
Молярная масса = 862 г/моль Количество = 0,136 .103 моль
Следовательно при омылении получится 0,136.103 моль пальмитата натрия (молярная масса = 278 г/моль) и 0,272 .103 моль стеарата натрия (молярная масса = 306 г/моль)
Масса пальмитата натрия = 37,8 кг
Масса стеарата натрия = 83,2 кг
Общая масса данных солей = 121 кг
Ответ записываем:
В 3 Вариант 1
Установите соответствие между структурной формулой органического вещества и общей формулой гомологического ряда, к которому относится это вещество.
| Структурная формула вещества | Общая формула гомологического ряда |
| ![]() 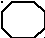 А) А)
![]() ![]()
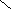 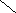 ![]()
![]() ![]() ![]() Б) Б)
![]()
 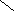 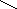
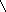 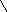  В) В)
![]()
![]() 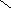 Г) ОН Г) ОН
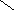 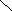 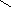  
О
|
СnH2n+2
СnH2n
СnH2n-2
СnH2n-4
СnH2n-6
СnH2n-8
СnH2n+2O2
СnH2nO2 |
Решение:
Необходимо запомнить общую формулу алканов ( ациклических углеводородов, в молекулах которых только одинарные связи между атомами углерода) СnH2n+2
В дальнейшем рассуждаем логически: каждая кратная связь образуется за счет отнятия 2-хатомов водорода, т.е если есть в молекуле одна двойная связь, то общая формула получается: СnH2n+2 -2 → СnH2n, наличие тройной связи или двух двойных : СnH2n+2 -4 → СnH2n-2 и т.д. ;
цикл образуется за счет отнятия 2-х атомов водорода, т.е. если есть в молекуле цикл, то общая формула получается: СnH2n+2 -2 → СnH2n
Вещества «А» : цикл и четыре двойные связи : СnH2n+2 -10 → СnH2n-8 Ответ : 6
Вещество «Б»: тройная и двойная связи: СnH2n+2 -6 → СnH2n-4 Ответ: 4
Вещество «В»: цикл и четыре двойные связи: СnH2n+2 -10 → СnH2n-8 Ответ: 6
Вещество «Г»: предельная одноосновная карбоновая кислота СnH2nO2 Ответ: 8
Ответ записываем:
В 4 Вариант 1
Определите сумму молярных масс (г/моль) органических веществ Д и Е, образующихся в результате следующих превращений:


![]()
![]() О С2Н5 NaOH\ H2O CuO,t Ag2O\NH3, H2O CH3OH\H+,t NaOH\ H2O
О С2Н5 NaOH\ H2O CuO,t Ag2O\NH3, H2O CH3OH\H+,t NaOH\ H2O





 A Б В Г Д +Е
A Б В Г Д +Е
CH3 O
Решение:
Сложный эфир при взаимодействии с гидроксидом натрия дает спирт и соль соответствующей кислоты, т.е. получается этанол С2Н5ОН и ацетат натрия
СН3СООNa.
С оксидом меди при нагревании взаимодействуют спирты. Следовательно, вещество «А» - это этанол. При взаимодействии спиртов с оксидом меди получается альдегид. В данном случае получится этаналь. Вещество «Б» - этаналь
Альдегиды окисляются аммиачным раствором оксида серебра до карбоновых кислот. В данном случае получается уксусная кислота. Вещество «В» - уксусная кислота
Карбоновые кислоты взаимодействуют со спиртами при нагревании в кислой среде с образованием сложных эфиров:
СН3СООН + СН3ОН = СН3СОО-СН3 + Н2О
Вещество «Г» - метиловый эфир уксусной кислоты ( метилацетат).
Сложный эфир при взаимодействии с гидроксидом натрия дает спирт и соль соответствующей кислоты, т.е. получается вещество «Д» - метанол СН3ОН ( Молярная масса = 32 г/моль) и вещество «Е» - ацетат натрия СН3СООNa (Молярная масса = 82 г/моль)
Сумма молярных масс = 32+82 = 114
Ответ записываем:
В 5 Вариант 1
Дана схема превращений:
t


AgNO3 A X

![]()
Cu HNO3 (конц) NH3(p-p) CH3CHO



Б … … У
Вычислите сумму молярных масс (г/моль) твердого при 200С неорганического вещества Х и органического вещества молекулярного строения У
Решение:
Медь способна вытеснять серебро из растворов солей серебра, т.к. медь более активный металл. В результате получается:
Сu + 2 AgNO3 = Cu(NO3)2 + Ag
Одно из веществ, получившихся в результате реакции будет веществом «А», другое – «Б». Серебро – простое вещество, не подвергается разложения, следовательно, вещество «А» - это нитрат меди. Все нитраты при нагревании разлагаются. Нитрат меди разлагается:
2Cu(NO3)2 = 2СuO + 4NO2 + O2
Вещество «Х» - твердое вещество, следовательно, это оксид меди. Молярная масса = 80 г/моль.
Вещество «Б» - серебро. При взаимодействии с концентрированной азотной кислотой образуются соли – нитраты, оксид азота (IV) и вода::
2HNO3 + Ag = AgNO3 + NO2 + H2O
С аммиаком может вступать в реакцию оксид азота как кислотный оксид. И так как ему соответствуют две кислоты азотная и азотистая, то при взаимодействии с основаниями или с аммиаком должно получатся две соли : нитрит и нитрат. Но данные соли не взаимодействуют с альдегидами CH3CHO. Следовательно, надо вспомнить химические свойства альдегидов и предложить предыдущее превращение. Альдегиды взаимодействуют с аммиачным раствором оксида серебра, который получают при смешивании нитрата серебра с раствором аммиака.
Следовательно, с аммиаком взаимодействует нитрат серебра и получается аммиачный раствор оксида серебра Ag2O.
Аммиачный раствор оксида серебра окисляет альдегиды в соответствующие кислоты. В данном случае получается уксусная кислота. СН3СООН. Молярная масса = 60 г/моль
Сумма молярных масс = 80+ 60 = 140
Ответ записываем:
В 6 Вариант 1
Уксусный ангидрид (СН3СО)2О легко взаимодействует с водой, образуя уксусную кислоту.
(СН3СО)2О + Н2О → 2 СН3СООН.
Какой объем (см3) водного раствора уксусной кислоты с массовой долей СН3СООН 90% (ρ= 1,06г/см3) следует добавить к 55 г раствора уксусного ангидрида в уксусной кислоте с массовой долей (СН3СО)2О 45%, чтобы получить 97-процентный раствор уксусной кислоты?


Решение:
Водный раствора уксусной 55 г раствор уксусного 97-процентный
кислоты с массовой долей ангидрида в уксусной раствор уксусной
СН3СООН 90% кислоте с массовой кислоты
(ρ= 1,06г/см3) долей (СН3СО)2О 45%


Х (г) 55 (г) 55 + Х (г)




Н2О СН3СООН (СН3СО)2О СН3СООН Н2О СН3СООН
0,1Х 0,9Х 24,75 (г) 30,25 (г) 53,35 + 0,97Х
0,24265 моль
Так как после смешивания вышеуказанных растворов получается раствор, состоящий из воды и уксусной кислоты, то можно сказать, что уксусный ангидрид полностью провзаимодействовал с водой, а вода была взята в избытке. Расчет ведем по ангидриду:
(СН3СО)2О + Н2О → 2 СН3СООН
1 моль 2 моль
0,24265 моль α = 0,4853 моль → 29,1176 г
В получившемся растворе масса уксусной кислоты будет равна:
0,9Х + 30,25 + 29,16 = 53,35 + 0,97Х
Находим «Х»:
0,07Х = 6,017
Х = 85,957 (г)
Масса исходного раствора уксусной кислоты равна 86,57 г. Объем этого раствора = m:ρ – 85,957 :1,06 = 81,092 см3
Ответ записываем:
В 7 Вариант1
К раствору медного купороса массой 24 г с массовой долей сульфата меди(II) 8% добавили некоторое количество насыщенного раствора сульфида натрия. Растворимость сульфида натрия в условиях эксперимента составляла 25 г на 100 г воды. После отделения осадка о казалось, что концентрация (моль/ дм3) ионов Na+ в растворе в шесть раз больше, чем S2-, Определите массу (г) насыщенного раствора сульфида натрия, использованного в описанном эксперименте.
Решение:

Cu2+0,012
 Раствор медного купороса массой 24 г с массовой долей
Раствор медного купороса массой 24 г с массовой долей
 сульфата меди(II) 8%
сульфата меди(II) 8%


 Насыщенный раствор сульфида натрия. Растворимость сульфида натрия в условиях эксперимента составляла 25 г на 100 г воды.
Насыщенный раствор сульфида натрия. Растворимость сульфида натрия в условиях эксперимента составляла 25 г на 100 г воды.
 Осадок CuS
Осадок CuS
S2- 0,012

 Раствор: концентрация (моль/ дм3) ионов Na+ в растворе в шесть раз больше, чем S2-,
Раствор: концентрация (моль/ дм3) ионов Na+ в растворе в шесть раз больше, чем S2-,


1,92 (г) Х (г)
0,012 моль 0,0128 Х (моль)







 Вода CuSO4 Вода Na2S Вода Na2SO4 Na2S
Вода CuSO4 Вода Na2S Вода Na2SO4 Na2S
Cu2+ SO42- 2Na+ S2- 2Na+ SO42- 2Na+ S2-
0,012 0,012 0,0256Х 0,0128Х
Так как в конечном растворе есть сульфид –ионы, значит сульфид натрия был в избытке и он будет присутствовать в конечном растворе.
Ионы меди все ушли в осадок. Их химическое количество в осадке равно химическому количеству ионов меди в медном купоросе до реакции = 0,012 моль
Значит и химическое количество сульфид ионов в осадке = 0,012 моль
До реакции сульфид-ионов было: 0,0128 Х моль. В осадок выпало 0,012 моль. Значит в растворе будет содержаться сульфид-ионов 0,0128Х – 0,012
До реакции ионов натрия было 0,0256Х моль. Все они будут находится в растворе. Их количество в 6 раз больше количество сульфид-ионов в растворе:
0,0256Х = 6 (0,0128Х – 0,012)
0,0085Х = 0,012
Х= 1,412
Масса сульфида натрия в насыщенном растворе = 1,412 г
Если 25 г сульфида натрия содержится в 125 г насыщенного раствора, то 1,412 г вещества должны содержаться в 125 х1,412 : 25 = 7,06 г
Ответ записываем:
В 8 Вариант 1
Установите соответствие между схемой химической реакции, протекающей в водном растворе, и суммой коэффициентов в сокращенном ионном уравнении реакции:
| Схема реакции | Сумма коэффициентов |
| А) Zn + KOH + H2O → Б) Al + HCl (изб) → В) Al2O3 + HNO3 (изб) → Г) BaCO3 + HCl (изб) → | 1) 4 2) 6 3) 7 4) 8 5) 12 6)13 |
Решение:
Оставим уравнения в молекулярном и ионном сокращенном видах:
А) Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Zn + 2 OH- + 2 H2O = [Zn(OH)4]2- + H2
Сумма коэффициентов = 1 + 2 + 2 + 1 + 1 = 7 Ответ : 3
Б) 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6 H+ = 2Al3+ + 3 H2
Сумма коэффициентов = 2 + 6 + 2 + 3 = 13 Ответ: 6
В) Al2O3 + 6HNO3= 2 Al(NO3)3 + 3H2O
Al2O3 + 6H+ = 2 Al3+ + 3 H2O
Сумма коэффициентов = 1 + 6 + 2 + 3 = 12 Ответ: 5
Г) BaCO3 + 2HCl = BaCl2 + H2O + CO2
BaCO3 + 2 H+ = Ba2+ + H2O + CO2
Сумма коэффициентов = 1 + 2 + 1 + 1 + 1= 6 Ответ: 2
Записывает ответ:
В 9 Вариант 1
Расставьте коэффициенты методом электронного баланса в уравнении окислительно-восстановительной реакции
KBr + K2Cr2O7 + H2SO4 → Br2 + K2SO4 + Cr2(SO4)3 + H2O
Укажите сумму коэффициентов перед веществами молекулярного строения.
Решение:
Находим элементы, которые изменили степень окисления. Составляем уравнения окисления и восстановления:
![]() 2Br- -2e = Br20 3 окисление ( KBr – восстановитель)
2Br- -2e = Br20 3 окисление ( KBr – восстановитель)
Cr2+6 + 3х2 е = Cr2+3 1 восстановление (K2Cr2O7 - окислитель)
Переносим коэффициенты в наше уравнение:
6KBr + 1K2Cr2O7 + H2SO4 → 3Br2 + K2SO4 + 1Cr2(SO4)3 + H2O
К остальным формулам коэффициенты находятся логически рассуждая:
Калия до реакции было 8 атома, после реакции должно быть тоже 8 атома. Это возможно в 4 формульной единице сульфата калия:
6KBr + 1K2Cr2O7 + H2SO4 → 3Br2 +4 K2SO4 + 1Cr2(SO4)3 + H2O
Серы после реакции получилось: 4 + 3 = 7 атома. Чтобы до реакции тоже было 4 атома серы надо поставить перед формулой серной кислоты коэффициент 7
6KBr + 1K2Cr2O7 + 7H2SO4 → 3Br2 +4 K2SO4 + 1Cr2(SO4)3 + H2O
Водорода до реакции 14 атомов. Чтобы после реакции также оставалось 14 атомов водорода надо перед формулой воды поставить коэффициент 7
6KBr + 1K2Cr2O7 + 7H2SO4 = 3Br2 +4 K2SO4 + 1Cr2(SO4)3 + 7H2O
В данной реакции веществами молекулярного строения являются:
7H2SO4 , 3Br2 , 7H2O
Сумма их коэффициентов = 17
Ответ записываем:
В 10 Вариант 1
К 40 дм3 смеси, состоящей из этана и аммиака, добавили 15 дм3 хлороводорода. После приведения новой газовой смеси к первоначальным условиям ее относительная плотность по воздуху составила 0,90. Укажите массовую долю (%) аммиака в исходной смеси. (Все объемы измеряла при Т = 200С, Р = 105 Па)
Решение:
Смесь 1: С2Н6 и NH3 + HCl → Смесь 2: С2Н6 и NH3 или HCl
С2Н6 и NH3 или HCl → смесь
n: Х моль 1 – Х моль 1 моль
m: 30Х (г) ? моль 0,9х29=26,1г/моль
Если в избытке был хлороводород и смесь 2 состоит из этана и хлороводорода, то молярная масса такой смеси должна быть от 30 г/моль до 36,5 г/моль. В нашем же случае она = 26,1 г/ моль, что отвечает условию: смесь состоит из этана и аммиака.
С2Н6 и NH3 → смесь
n: Х моль 1 – Х моль 1 моль
m: 30Х (г) 17-17Х моль 26,1г/моль
30Х + 17 – 17Х = 26,1 13Х = 9,1 Х = 0,7 моль
Т.е. в смеси 2 объемная доля этана = 70%, объемная доля аммиака = 30%
Весь хлороводород вступил в реакцию: HCl + NH3 = NH4Cl
С 15 дм3 хлороводорода прореагировала 15 дм3 аммиака. Поэтому, объем конечной смеси = 40 – 15 = 25 дм3. В нем 30% аммиака, что составляет 7,5 дм3. Следовательно, в исходной смеси объем аммиака = 7,5 + 15 = 22,5 дм3 .
Смесь 1: этан аммиак → смесь
V: 17,5 22,5 40 дм3
n: 0,78125 1,00446 1,78571 моль
m: 23,44 17,0765 40,5165 г
w(NH3) = 17,0765 : 40,5165 = 0,42147 или 42,147%
Ответ записываем:
В 10 (2012) Вариант1
Озон (48) и кислород (32) = смесь (8,8 * 4 = 35,2) Смесь – Оп п= 35,2 :16 =2,2
Ацетилен(26) Бутан (58) 2-метилпропан(58) = смесь
Х моль 1-Х моль 1 моль
26Х 58 – 58Х 53,2 (26,6*2)
26Х +58-58Х = 53,2 32Х = 4,8 Х= 0,15
Количество смеси = 100: 53,2 =0,188 моль
Количество ацетилена = 0,188 * 0,15 = 0,027 моль
Количество бутана и 2-метилпропана = 0,188 – 0,027 = 0,161 моль
С2Н2+2,272 О2,2 = 2 СО2 + Н2О Количество О2,2= 0,045 моль
С4Н10 +5,909 О2,2 = 4 СО2 +5 Н2О Количество О2,2= 0,951 моль
Общее количество О2,2= 0,996 моль Объем = 22,3 л






 А)
А) 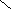
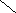

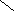
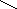
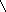
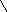
 В)
В) 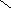 Г) ОН
Г) ОН