
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ

- Предмет химия
- Тема урока « Скорость химических реакций»
- Аудитория – 11 класс ( УМК Габриелян О.С.),
- МОУ « Русская православная классическая гимназия имени Сергия Радонежского»
- Цель: объяснить понятие скорости химической реакции и её зависимость от различных факторов
- Работа с презентацией по ходу урока

СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель урока:
Изучить понятие скорости химической реакции и её зависимости от различных факторов.

Химическая кинетика - это раздел физической химии, который изучает скорость химической реакции и факторы, влияющие на её величину.

СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость химической реакции – это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени

Факторы, влияющие на скорость реакции.

Фактор
Пример
Вывод

Фактор
Пример
1. Природа реагирующих веществ
1) Zn+HCl
2) Mg+HCl
Вывод

Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
Вывод
Чем активнее реагируют вещества, тем больше скорость реакции

Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Вывод
Zn+HCl
Чем активнее реагируют вещества, тем больше скорость реакции

Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Вывод
Zn+2HCl ZnCl 2 +H 2
Чем активнее реагируют вещества, тем больше скорость реакции
Чем больше концентрация, тем больше скорость реакции
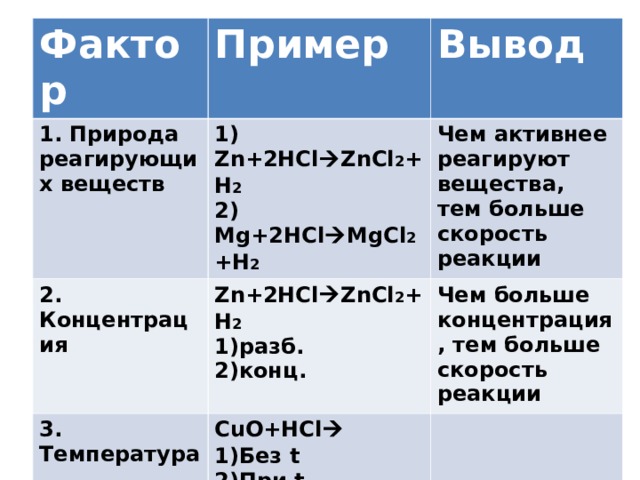
Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Вывод
Zn+2HCl ZnCl 2 +H 2
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
CuO+HCl
Чем больше концентрация, тем больше скорость реакции

Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Вывод
Zn+2HCl ZnCl 2 +H 2
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
CuO+2HCl CuCl 2 +H 2 O
Чем больше концентрация, тем больше скорость реакции
Чем выше t , тем больше скорость реакции

Фактор
1. Природа реагирующих веществ
Пример
2. Концентрация
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
Чем активнее реагируют вещества, тем больше скорость реакции
Zn+2HCl ZnCl 2 +H 2
3. Температура
4. Площадь соприкосновения веществ
Чем больше концентрация, тем больше скорость реакции
CuO+2HCl CuCl 2 +H 2 O
Чем выше t , тем больше скорость реакции
Fe+HCl

Фактор
1. Природа реагирующих веществ
Пример
2. Концентрация
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
Zn+2HCl ZnCl 2 +H 2
4. Площадь соприкосновения веществ
Чем больше концентрация, тем больше скорость реакции
CuO+2HCl CuCl 2 +H 2 O
Чем выше t , тем больше скорость реакции
Fe+2HCl FeCl 2 + H 2
Чем больше площадь соприкосновения, тем больше скорость реакции

Фактор
1. Природа реагирующих веществ
Пример
2. Концентрация
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
3. Температура
Zn+2HCl ZnCl 2 +H 2
Чем активнее реагируют вещества, тем больше скорость реакции
Чем больше концентрация, тем больше скорость реакции
4. Площадь соприкосновения веществ
CuO+2HCl CuCl 2 +H 2 O
Чем выше t , тем больше скорость реакции
Fe+2HCl FeCl 2 + H 2
5. Катализатор
Чем больше площадь соприкосновения, тем больше скорость реакции
H 2 O 2
- Без катализатора
- С катализатором

Фактор
Пример
1. Природа реагирующих веществ
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
Zn+2HCl ZnCl 2 +H 2
CuO+2HCl CuCl 2 +H 2 O
Чем больше концентрация, тем больше скорость реакции
4. Площадь соприкосновения веществ
Чем выше t , тем больше скорость реакции
Fe+2HCl FeCl 2 + H 2
5. Катализатор
2H 2 O 2 2H 2 O+O 2
Чем больше площадь соприкосновения, тем больше скорость реакции
- Без катализатора
- С катализатором
Катализатор – это вещество, увеличивающее скорость реакции

Ответьте на вопросы
- 1 . Скорость химической реакции цинка с раствором серной кислоты не зависит от :
- 1) Числа взятых гранул цинка ;
- 2) Степени измельчения цинка ;
- 3) Концентрации серной кислоты;
- 4) Температуры.

Ответьте на вопросы
- 2 . Одинаковые кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой если :
- 1) Разбавить кислоту ;
- 2) Увеличить концентрацию кислоты ;
- 3) Увеличить давление ;
- 4) Уменьшить температуру.

Ответьте на вопросы
- 3 . Скорость реакции разложения пероксида водорода увеличится при :
- 1) Разбавлении раствора ;
- 2) Увеличении давления ;
- 3) Внесения катализатора ;
- 4) Охлаждении раствора.

Ответьте на вопросы
- 4 . Химическая кинетика - раздел физической химии, изучающий:
- 1) Принципиальную возможность самопроизвольного протекания химического процесса в том или ином направлении;
- 2) Тепловые эффекты химических реакций;
- 3) Скорость протекания химических реакций во времени, факторы, влияющие на её величину;
- 4) Возможный механизм химических реакций с учётом строения молекул участвующих в них веществ.

Ответьте на вопросы
- 5 . С большей скоростью с кислородом при комнатной температуре реагирует :
- 1) Fe;
- 2) Cu;
- 3) Al ;
- 4) Na .

Проверьте себя.
- 1) 1 ;
- 2) 2 ;
- 3) 3;
- 4) 3;
- 5) 4.

Домашнее задание: §15 + вопросы после параграфа
Спасибо за внимание!









































