Строение и физические свойства воды. Значение, применение и
охрана водных ресурсов.
Цели:
Образовательные:
1) Показать взаимосвязь между строением и физическими свойствами воды;
2) Выяснить, какие свойства воды являются аномальными, и как это влияет на облик планеты.
3) Ознакомить с факторами загрязнения природных вод и путями решения этой проблемы.
Воспитательные:
1) Развивать эстетическое восприятие окружающей природы;
2) Развивать чувство бережного отношения к водным ресурсам.
Развивающие:
1)формировать умение самостоятельно работать с источниками информации;
2) способствовать развитию целостного научного мышления о явлениях, науках, их
взаимосвязи, реализуя межпредметные связи курсов химии, биологии, физики, географии.
Оборудование:
компьютер, мультимедийный проектор, экран, лазерная указка, предметные стёкла, стальные
иголки или металлические скрепки, кристаллизаторы с водой.
Эпиграф (на доске)
Если в столь простом веществе, как вода,
наукой не всё было открыто, то как много ещё
остаётся неясного и точно не исследованного во
всём окружающем нас материальном мире…
Н.Д.Зелинский
Урок начинается со слов Антуана де Сент–Экзюпери (слайд 1)

Вода с одной стороны является самым простым и обычным веществом. В тоже время она может преображаться в самые разнообразные формы в виде дождя, снега, инея, тумана, облака и т. д. И, наверное, поэтому, она была и остаётся источником вдохновения поэтов, художников, композиторов. Поэты и писатели всех времён воспевали в своих произведениях красоту морей и рек, шум водопада, загадочность подводного мира. (слайд 2).
Именно любовь к водной стихии, восхищение его многоликостью помогла создать Айвазовскому Ивану Константиновичу такие шедевры, как «Чёрное море» и «Шторм в ночи». (слайд 3)

А Левитан Исаак Ильич создал свои великие картины «Весна. Большая вода» и «Озеро».

Эти картины, показывающие два противоположных состояния водной глади, как бы показывают состояние души этих великих художников. Какие черты их характера и заветные мечты можно увидеть на этих полотнах? ( По данному вопросу учащимся можно предложить научную работу «Образ (многоликость) воды в творчестве художников, поэтов, писателей»)
Далее учащимся предлагается просмотреть видеофрагменты и сделать вывод. (слайд 5)

Как предполагаемый вывод можно использовать слова В.И. Вернадского «Нет земного вещества – минерала, горной породы, живого тела, которое её не заключало бы. Всё земное вещество ею проникнуто и охвачено».
Действительно, такие твёрдые вещества, как гипс и рис в своём составе содержат воду. Её находят в пустынях, которые называются безводными. Вода содержится в горных породах. Даже в расплавленной магме она присутствует в значительных количествах и выделяется в виде пара при извержении вулканов. (слайд 6)

Учитель: Вспомните из курса географии, как распределена вода на территории Земли?
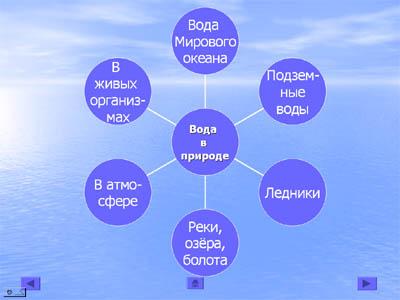
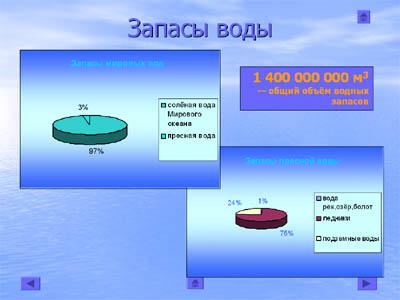
Ученик:Вода покрывает 3/4 (70% земной поверхности)
97 % - солёная вода Мирового океана;
2,2 % - ледники покровные и горные;
0,6 % - пресная вода рек, озёр, подземных горизонтов;
0,2 % - в атмосфере Земли. (слайд 7)
Учитель: Какую роль играет вода в жизни живых организмов? (Вопрос можно дать заранее группе учащихся по направлениям: 1) для растений; 2) для животных; 3) для человека. (Более подготовленные учащиеся могут создать свои слайды.)
Ученик:Находясь в большом количестве в живых организмах, вода играет огромную роль в их
жизнедеятельности:
3500 млн. лет назад в океанах появились первые живые существа. И только благодаря воде жизнь продолжает существовать.
Живые организмы состоят примерно на ¾ из воды.
Большие количества воды потребляют растения. Подсчитано, что для получения 1 т пшеницы нужно около 1500 т воды, хлопчатника – 10000 т. (слайд 8)


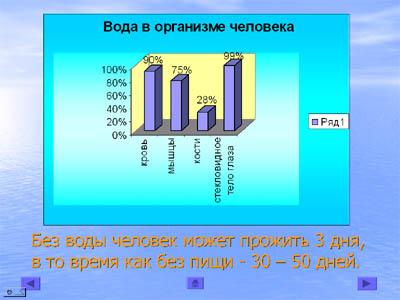
В человеческом организме 35 л жидкости непрерывно осуществляют «орошение» тела. В этот объём входят: 5л крови, 2 л лимфы, 28 л внутриклеточной и внеклеточной жидкости. Все эти жидкости – водные растворы органических и неорганических веществ. (слайд 10)

Учитель: Велико значение воды в природе.
Учитель: Какое значение имеет большой круговорот воды в обеспечении водой планеты?

Ученик:
Благодаря круговороту воды на сушу поступает большое количество влаги и тепла. Даже территории, находящиеся далеко от океанов, могут получить необходимое количество воды для питания рек, озёр, подземных вод. Наряду с осадками воздушные массы, приходящие со стороны океана, приносят тепло в зимнее время и прохладу летом. Благодаря круговороту воды суша не становится безжизненной пустыней. (слайд 13)
Учитель: Почему воду называют самым аномальным веществом в мире?
Для того чтобы ответить на этот вопрос, выслушаем мнения экспертов, которые работали в разных группах.
Дальше идёт выступление I группы учащихся, которые заранее подготовились по такому заданию:
— Рассмотрите график температур кипения и плавления водородных соединений элементов VIгруппы главной подгруппы. При какой температуре вода должна кипеть, а при какой – замерзать?
Соответствует ли это действительности? (слайд 14)
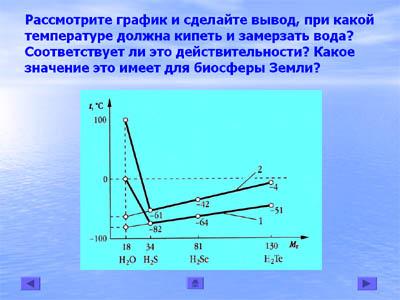
Вывод учащихся:
При сравнении водородных соединений элементов VIгруппы видно, что вода должна замерзать при около -100°С, кипеть – около -80°С. На самом деле вода замерзает при 0°С, а кипит при 100°С.
Учитель: Существуют ли на Земле места, где температура ниже -80°С? В каком виде находилась бы
вода на планете, если температуры плавления и кипения соответствовали бы графику? К чему бы это привело?
С этим заданием работали учащиеся IIгруппы и они сделали соответствующий вывод:
Самая низкая температура зафиксирована в Антарктиде. Она равна -89,2°С. Но средняя температура материка намного выше. На остальной части Земли намного теплее.
При такой температуре кипения и замерзания вся вода бы на Земле испарилась и невозможна была бы жизнь. Наша планета превратилась бы в безводную пустыню.
(слайд 15)

Задание III группе:
— По какой формуле вычисляется плотность? ( =m/V)
=m/V)
— Меняется ли масса воды с изменением температуры? (не меняется)
— Что происходит на холоде с закрытой бутылкой, до краёв наполненной водой? Почему? В какую сторону меняется объём воды при переходе из жидкого состояния в твёрдое? Как при этом меняется плотность?
Вывод:
На холоде бутылка с водой разбивается, так как объём льда больше, чем объём воды.
 воды= mводы/Vводы;
воды= mводы/Vводы;  льда = mльда/Vльда; mводы = mльда; VводыVльда . Отсюда видно, что плотность льда будет меньше, чем воды.
льда = mльда/Vльда; mводы = mльда; VводыVльда . Отсюда видно, что плотность льда будет меньше, чем воды.
Задание IVгруппе учащихся (слайд 16)
Рассмотрите график. Сделайте вывод о значении этого свойства воды для живых существ.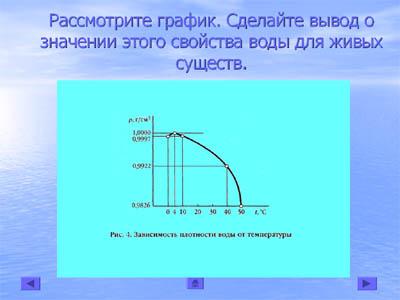
Вывод учащихся:
Плотность веществ с понижением температуры повышается. А плотность твёрдого льда меньше, чем у жидкой воды. У воды наибольшая плотность при температуре 4°С.
Если бы плотность воды при замерзании увеличивалась, то при приближении зимы поверхностные слои, охлаждаясь до 0°С, опускались бы на дно. В конечном счёте, вся вода приобрела бы температуру 0°С. Далее вода начала бы замерзать, образующийся лёд погружался бы на дно и водоём промёрз бы на всю его глубину.
При этом многие формы жизни в местах, где бывает зима, в воде не могли бы существовать.
Задание V группе учащихся: Что такое теплоёмкость? (количество теплоты, необходимое для нагревания 1 кг вещества на 1°С). Чему она равна у воды? [(4,18 Дж/(г·К)].Какова она у остальных жидкостей? (Работа по справочнику)
Вывод:
У воды большая удельная теплоёмкость (4,18 Дж/(г·К).Для сравнения приводим значения удельной теплоёмкости некоторых веществ: песок 0,79; известняк 0, 88; хлорид натрия 0,88;
глицерин 2,43; этиловый спирт 2,85.
И, как уже было сказано выше (слайд 11), в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днём или при переходе от зимы к лету так же медленно нагревается. Так зимние и ночные температуры повышаются, а летние и дневные - понижаются, то есть амплитуда температур уменьшается.
Небольшая лабораторная работа:
Возьмите два предметных стекла, на одну из них положите несколько капель воды и прикройте другим. Попробуйте разъединить стёкла. Что наблюдается? Почему так происходит?
На поверхность воды в кристаллизаторе осторожно положите стальную иголку (лучше железную скрепку). Что наблюдается? Почему?
Почему водные насекомые водомерки могут бегать по поверхности водоёмов?
Вывод:Вода имеет очень высокое поверхностное натяжение воды – 0,073 Н/м при 20°С. По
прочности на разрыв струя воды не уступает стальной проволоке того же сечения.
Обобщение учителя.
Итак, вернёмся к первоначальному вопросу: «Почему воду называют самым аномальным веществом в мире?»
Вода имеет аномально высокие температуры кипения и замерзания.
Плотность воды при переходе её из твёрдого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает, являясь максимальной при 4°С.
Вода обладает аномально высокой теплоёмкостью.
У воды аномально высокое поверхностное натяжение.
Учитель: Какова причина всех этих аномалий?
Объяснение учителя:
Молекула воды образуется при взаимодействии двух атомов водорода и одного атома кислорода. Каждый атом водорода имеет один неспаренный s-электрон. В атоме кислорода два неспаренных р-электрона. При перекрывании двух р-электронных облаков атомов кислорода с s-электронными облаками двух атомов водорода образуются две полярные ковалентные связи (слайд 18).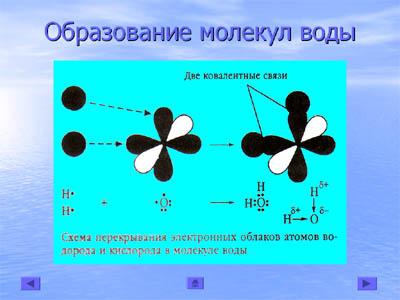
При этом общие электронные пары, образующие химические связи, смещены к атому кислорода, как к более электроотрицательному элементу. В структурной формуле это смещение показано знаками  + и
+ и -. р-орбитали взаимно перпендикулярны, и угол между связями должен быть 90°. Но из-за взаимного отталкивания электронных облаков двух атомов водорода этот угол становится равным 104,5°. Молекула воды представляет собой диполь. Это значит, что с одной стороны она имеет положительный заряд (+), а с другой - отрицательный заряд (-).
-. р-орбитали взаимно перпендикулярны, и угол между связями должен быть 90°. Но из-за взаимного отталкивания электронных облаков двух атомов водорода этот угол становится равным 104,5°. Молекула воды представляет собой диполь. Это значит, что с одной стороны она имеет положительный заряд (+), а с другой - отрицательный заряд (-).
Молекулы воды имеют полярную структуру, чем объясняется их склонность к объединению в более крупные комплексы. Это явление называется ассоциацией молекул.Лед имеет структуру, похожую на структуру воды.В структуре льда есть пустые пространства. Вот почему лед легче, чем вода, и плавает на ее поверхности. (слайд 19)
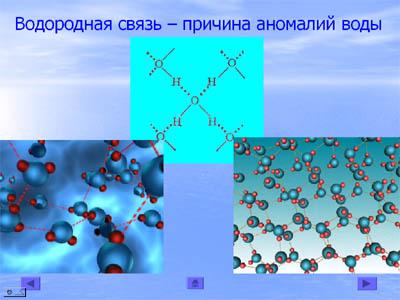
Доказательство ассоциации молекул воды - структура снежинок. Хотя в природе и не существует двух одинаковых снежинок, каждая из них имеет правильную гексагональную форму.
Высокие температуры плавления и кипения также объясняются наличием водородной связи. Прочность четырёх водородных связей соизмерима с прочностью ковалентной связи.
Благодаря полярной структуре молекул вода может растворять другие полярные вещества, например, многие соли, кислоты, щёлочи и т. д.Поэтому вода океанов и морей содержит много растворённых веществ. Даже пресные воды рек и озёр являются растворами многих веществ.
Учитель: Как же получить абсолютно чистую воду?
Вспомним способы разделения смесей. Вода в реке может быть мутной от взвешенных частиц.
Как можно разделить воду от таких примесей?
Ученик: Можно использовать фильтрование. Взвешенные частицы не проходят через фильтровальную бумагу.
Учитель:Но это ещё не чистая вода, она содержит растворённые вещества, которые не остаются на фильтре. Для получения чистой воды её перегоняют нагреванием до кипения с последующим охлаждением пара в приборе, называемом дистиллятором. Такой метод получения чистой воды называется дистилляцией, а сама вода – дистиллированной, которая и обладает всеми вышеуказанными физическими свойствами.
Рассмотрите слайд 20.
Учитель:
Много ли воды на Земле? Сколько воды можно использовать для питья? ( Морская вода не подходит, ледники расположены далеко, подземные воды нужно поднять на поверхность, болотная вода не пригодна для питья.Значит, доступной воды – менее 1 %)
Не только для питья, но и для многих других целей необходима пресная вода. К основным потребителям её относятся: сельское хозяйство (70 %), промышленность, включая энергетику (20 %) и коммунальное хозяйство (15 %). В промышленном производстве наиболее водоёмкими являются химическая, целлюлозно-бумажная и металлургическая промышленность.
Задание:
Принято считать, что житель благоустроенного города расходует в среднем в сутки 250 л воды. Сколько истратит за год семья из четырёх человек?
Потребление человечеством пресной воды неимоверно растёт (слайд 21), особенно с XIX века.
Отсюда вытекает проблема бережного отношения к водным ресурсам.
Основными факторами загрязнения воды являются:
Воды, сбрасываемые после использования человеком, называются сточными. Сточные воды предприятий, содержащие ядовитые вещества, часто сбрасывают в водоёмы без предварительной очистки. В Чувашской Республике сточные воды большинства предприятий проходят очистку на очистных сооружениях примерно по таким стадиям. (видеофрагмент слайда 23)
Основные пути решения проблемы загрязнения водных ресурсов:
Рациональное использование пресной воды.
Необходимо строительство очистных сооружений. Использованную воду возвращать в природные водоёмы только после очистки.
Многократное использование воды на промышленных предприятиях.
Разработка новых способов очистки вод и переработки промышленных отходов.
Запрет на проведение ядерных испытаний в водах Мирового океана.
Выводы урока:
Вода в природе существует в трёх агрегатных состояниях: твёрдом - в виде ледников; жидком – в морях и океанах, реках и озёрах; парообразном – в атмосфере.
Вода имеет огромное значение в природе и для человека как терморегулятор, растворитель и переносчик веществ, составной частью и средой обитания живых организмов.
Физические свойства воды являются аномальными величинами, что объясняется её строением.
Именно аномальные физические свойства воды дают возможность развития жизни на Земле.
Запасы воды небесконечны. Необходимо беречь водные ресурсы.
Проверку усвоения знаний можно проводить отгадыванием кроссворда.
|
|
|
|
|
|
|
|
|
|
|
| 1 | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2 | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 3 | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 5 | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 6 | | | | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 7 | | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8 | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 9 | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 10 | | | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 11 | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 12 | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 13 | | | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 14 | | | | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
| 15 | | | | | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| По горизонтали: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1) Самое аномальное вещество в мире; |
|
|
|
|
|
|
|
|
|
|
|
| 2) Молекула с противоположно заряженными полюсами; |
|
|
|
|
| 3) Твёрдое агрегатное состояние воды; |
|
|
|
|
|
|
|
|
|
|
|
| 4) Объединение частиц в более крупные комплексы; |
|
|
|
|
|
|
| 5) Однородная прозрачная смесь; |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 6) Физическая величина, показывающая, какое количество теплоты необходимо сообщить телу, чтобы нагреть его на 1 °С; |
| 7) Водная оболочка Земли; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8) Переход твёрдого вещества в жидкое; |
|
|
|
|
|
|
|
|
|
|
| 9) Парообразование; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 10) Переход вещества из газообразного состояния в жидкое или твёрдое. |
| 11) Удаление вредных примесей воды; |
|
|
|
|
|
|
|
|
|
|
|
| 12) Самый распространенный химический элемент Вселенной; |
|
|
| 13) Прибор для получения дистиллированной воды. |
|
|
|
|
|
|
|
|
| 14) Стадия очистки воды; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 15) Масса единичного объёма вещества. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| По вертикали: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1) Причина аномальности воды. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|





















 =m/V)
=m/V)


 + и
+ и











