Входная контрольная работа
Вариант №1
1
Выберите два утверждения, в которых говорится об алюминии как о простом веществе.
1) Сульфид алюминия используется для производства сероводорода.
2) Основной недостаток алюминия как конструкционного материала – малая прочность.
3) В природе алюминий встречается почти исключительно в виде соединений.
4) Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
5) Концентрация алюминия в морской воде крайне незначительна.
Запишите номера выбранных ответов.
&%end_page&%
2
На приведённом рисунке изображена модель атома химического элемента.
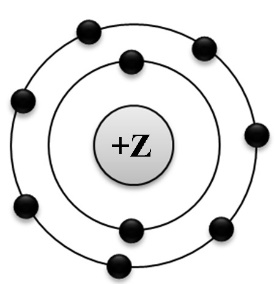
Запишите в таблицу номер периода (X), в котором химический элемент расположен в Периодической системе Д.И. Менделеева, и порядковый номер (Y) данного химического элемента. (Для записи ответа используйте арабские цифры.)
3
Расположите химические элементы –
1) магний 2) кремний 3) алюминий
в порядке увеличения неметаллических свойств образуемых ими простых веществ.
Запишите указанные номера элементов в соответствующем порядке.
&%end_page&%
4
Установите соответствие между формулой вещества и степенью окисления азота в данном веществе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА |
| СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА |
|
А) |
HNO2
| |
Б) |
(NH4)2S
| |
В) |
Fe(NO3)2
|
|
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
&%end_page&%
5
Из предложенного перечня выберите два вещества с ионной связью.
|
1) |
CCl4
|
|
2) |
KOH
|
|
3) |
HF
|
|
4) |
Na2SO4
|
|
5) |
SCl2
|
Запишите номера выбранных ответов.
&%end_page&%
6
Из предложенного перечня веществ выберите оснóвный оксид и основание.
|
1) |
Al2O3
|
2) |
CO
|
3) |
Al(OH)3
|
4) |
BaO
|
5) |
Ca(OH)2
|
Запишите в поле ответа сначала номер оснóвного оксида, а затем номер основания.
&%end_page&%
7
Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО |
| РЕАГЕНТЫ |
|
|
| |
1) |
Na2O, Ba(OH)2
| |
2) |
Cl2, Na2SO4
| |
3) |
S, H2O
| |
4) |
AgNO3, KOH
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
&%end_page&%
8
&%end_ Из предложенного перечня выберите схемы двух реакций, которые относятся к реакциям разложения.
|
1) |
Cu(OH)2 → CuO + H2O
|
|
2) |
FeCl2 + Cl2 → FeCl3
|
|
3) |
Mg(OH)2 + H2SO4 → MgSO4 + H2O
|
|
4) |
Cu(NO3)2 → CuO + NO2 + O2
|
|
5) |
BaCl2 + K2SO4 → KCl + BaSO4
|
Запишите номера выбранных ответов.
page&%
9
&% end_page&%
При полной диссоциации 1 моль каких двух из представленных веществ образуется 3 моль анионов?
|
1) |
Na2CO3
|
|
2) |
Ca(NO3)2
|
|
3) |
Fe2(SO4)3
|
|
4) |
K2SiO3
|
|
5) |
CrCl3
|
Запишите номера выбранных ответов.
10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
H+ + OH– = H2O
|
1) |
HF
|
|
2) |
Ba(OH)2
|
|
3) |
HBr
|
|
4) |
H2SO4
|
|
5) |
Zn(OH)2
|
|
6) |
Mg(OH)2
|
Запишите номера выбранных ответов.
&%end_page&%
Часть 2
11
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
NH3 + CuO → Cu + N2 + H2O
Определите окислитель и восстановитель.
&%end_page&%
12
После пропускания через раствор серной кислоты 0,448 л аммиака (н.у.) получили 66 г раствора сульфата аммония. Вычислите массовую долю соли в полученном растворе.
В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).


















