ГУО «Средняя школа № 14 г. Новополоцка»
Урок по химии
«Водород, его получение и применение»
Подготовила учитель химии
Шах О.А.
Новополоцк, 2015
Цели урока: Продолжить формирование понятий о химических свойствах и применении простых веществ на примере водорода.
Задачи: - продолжить формирование представлений понятий: «водород – химический элемент», «водород – простое вещество».
- повторить нахождение водорода в природе, физические свойства водорода.
- создать условия для расширения кругозора учащихся через ознакомление с методами получения водорода в промышленности и в лаборатории и способами собирания его.
- создать условия для развития логического мышления, памяти, речи; для формирования экологического мышления.
Оборудование и реактивы: прибор для получения газов, цинк, соляная кислота; мультимедийный проектор, компьютер, экран.
Тип урока: Комбинированный урок.
Методы, используемые на уроке: Проблемный вопрос, дифференцированное обучение, частично-поисковый метод, диалог, индукция, дедукция, рассказ, демонстрационный опыт, взаимная оценка.
Формы работы на уроке: Фронтальная письменная, фронтальная устная; индивидуальная работа с учебником, доской; самостоятельная работа учащихся дома (поиск и выбор информации к уроку).
План урока
Организационный момент (2 мин.): Проверить наличия тетрадей, письменных принадлежностей, учебников у детей. Организовать внимание детей учителем на себя. Приветствие.
Введение (3 мин.). Учитель: Странным на первый взгляд делом занялся однажды английский учёный Кавендиш: он стал пускать мыльные пузыри. Но это было не развлечение.
Перед этим Кавендиш заметил, что, когда железные опилки обливают серной кислотой, появляется много пузырьков какого-то газа. Что это за газ? Учёный вывел его по трубочкам из сосуда. Газ был невидим. Имеет ли он запах? Нет. Тогда Кавендиш наполнил им мыльные пузыри, и они легко поднялись вверх! А если поджечь газ? Он загорался голубоватым пламенем, но что удивительно – при горении получалась вода! Кавендиш назвал новый газ горючим воздухом. Ведь он, как и обычный воздух, был без цвета и запаха. Всё это происходило во второй половине 18-ого века. А позже французский химик Лавуазье сделал обратное: получил «горючий газ» из воды. Он же дал новому газу и другое имя – гидрогениум, т.е. … или «рождающий воду». Задать учащимся вопрос: «О чем сегодня пойдет речь, ребята? Что является целью нашего урока?».
3. Проверка знаний (7 мин.). Учащимся предварительно раздаются листочки с заданиями. Они выполняют задания, затем сдают листочки. Совместно с учителем проверяют правильность выполненных заданий.
Запишите формулы веществ в соответствующие столбцы таблицы: P2O5, I2, HNO3, Na2O, K2SO4, Fe, H3PO4, N2, Na2SiO3.
| оксиды | кислоты | соли |
| 1. 2. | 1. 2. | 1. 2. |
|
2.. |
|
Тест «Да-Нет-ка»
1 - Водород означает «кислоты рождающий» (нет)
2 - Самый распространенный во Вселенной (да)
3 - Его валентность равна - II (нет)
4 - В лаборатории получают при взаимодействии металлов с кислотами. (да)
5 - Впервые получен Ж. Пристли. (нет)
6 - Легче воздуха в 14,5 раз (да)
7 - Взаимодействует с металлами и неметаллами. (да)
8 - Простое вещество водород имеет формулу Н. (нет)
9 - Восстанавливает металлы из оксидов. (да)
- При горении образует много энергии. (да)
4.Изучение нового материала (20 мин.).
Тема урока Водород, его получение и свойства.
Слово учителя: Водород – самый распространенный элемент во Вселенной. Водород составляет около 70 % массы Солнца и звезд. Основная масса звезд состоит из водорода: Юпитер, Сатурн – 92% Н, 8 % Н е, 0,1 % все остальные химические элементы; водород преимущественно составляет межзвездное вещество. Водород входит в состав основного вещества Земли – воды. Вероятно, когда-то водород входил и в атмосферу Земли. Но из-за своей легкости он способен покидать атмосферу, поэтому доля водорода в воздухе ничтожно мала. В связанном виде водород составляет 0,76 % массы Земли.
«История открытия водорода».
Водород был известен еще в XVI в. Теофрасту Парацельсу (1493-1541), его получали также Ван -Гельмонт (1577-1644), Роберт Бойль (1627-1691), Николя Лемери (1645-1715), Михаил Васильевич Ломоносов(1711-1765), Джозеф Пристли и другие ученые.
Русское название "водород" было предложено уже в 19 веке химиком М.Соловьевым; название сразу прижилось и в дальнейшем не менялось.
Учитель : Ребята, давайте вспомним физические свойства водорода?
Водород — это самый легкий газ (он в 14,4 раза легче воздуха) – (доказать решением задачи) не имеет цвета, вкуса и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен.
Физкультминутка (2 мин): Проводит подготовленный ученик, учащиеся повторяют за ним все движения по тексту.
Это лёгкая забава
Это лёгкая забава —
Повороты влево-вправо.
Нам известно всем давно —
Там стена, а там окно. (Повороты туловища вправо и влево.)
Приседаем быстро, ловко.
Здесь видна уже сноровка.
Чтобы мышцы развивать,
Надо много приседать. (Приседания.)
А теперь ходьба на месте,
Это тоже интересно. (Ходьба на месте.)
Учитель: «Продолжаем изучать новый материал и переходим к изучению способов получения водорода». Учитель дает задание учащимся – самостоятельно поработать с учебником С.146-147, выписать основные способы получения водорода в промышленности и лаборатории.
Конспект. Получение в лаборатории:
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
Zn + 2HCl = ZnCl2 + H2
2.Взаимодействие натрия с водой:
2Na + 2H2O =2NaOH + H2
В промышленности:
1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O + C ⇔ H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ⇔ CO + 3H2 (1000°C)
Каталитическое окисление кислородом:
2CH4 + O2 ⇔ 2CO + 4H2
4.Крекинг и реформинг углеводородов в процессе переработки нефти.
Затем учитель вместе с помощником показывает демонстрационный опыт получения водорода взаимодействием цинка с соляной кислотой, показывая реальность получения водорода на практике.
Слово учителя: Вот какая история произошла с французским химиком, директором парижского музея науки Пилатом де Розье. Как-то он решил проверить, что будет, если вдохнуть водород. До него никто такого эксперимента не проводил. Не заметив никакого эффекта, учёный решил убедиться, проник ли водород в лёгкие? Он ещё раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в лёгких экспериментатора смешался с воздухом и произошёл сильный взрыв. « Я думал, что у меня вылетели все зубы вместе с корнями», - так Розье характеризовал испытанные ощущения. Эксперимент чуть не стоил ему жизни.
Следующий этап – это сообщения учащихся о применении водорода в различных сферах жизни человека. Учащиеся докладывают сообщения, класс кратко конспектирует, после каждого сообщения учащиеся задают вопросы, дискутируют. В конце учитель еще раз с помощью интерактивной презентации повторяет применение водорода, рассказывает о новых сферах применения.
Ученик 1. Металлургическая промышленность
Ученик 2. Производство удобрений
Ученик 3. Получение HCl.NH3
Ученик 4. Альтернативный источник энергии
Закрепление этого этапа – На столе учителя лежат в виде лучиков солнца разные сферы применения, учащиеся по очереди подходят и берут один лучик и рассказывает, что он запомнил об этой сфере применения.
Закрепление (3 мин.):
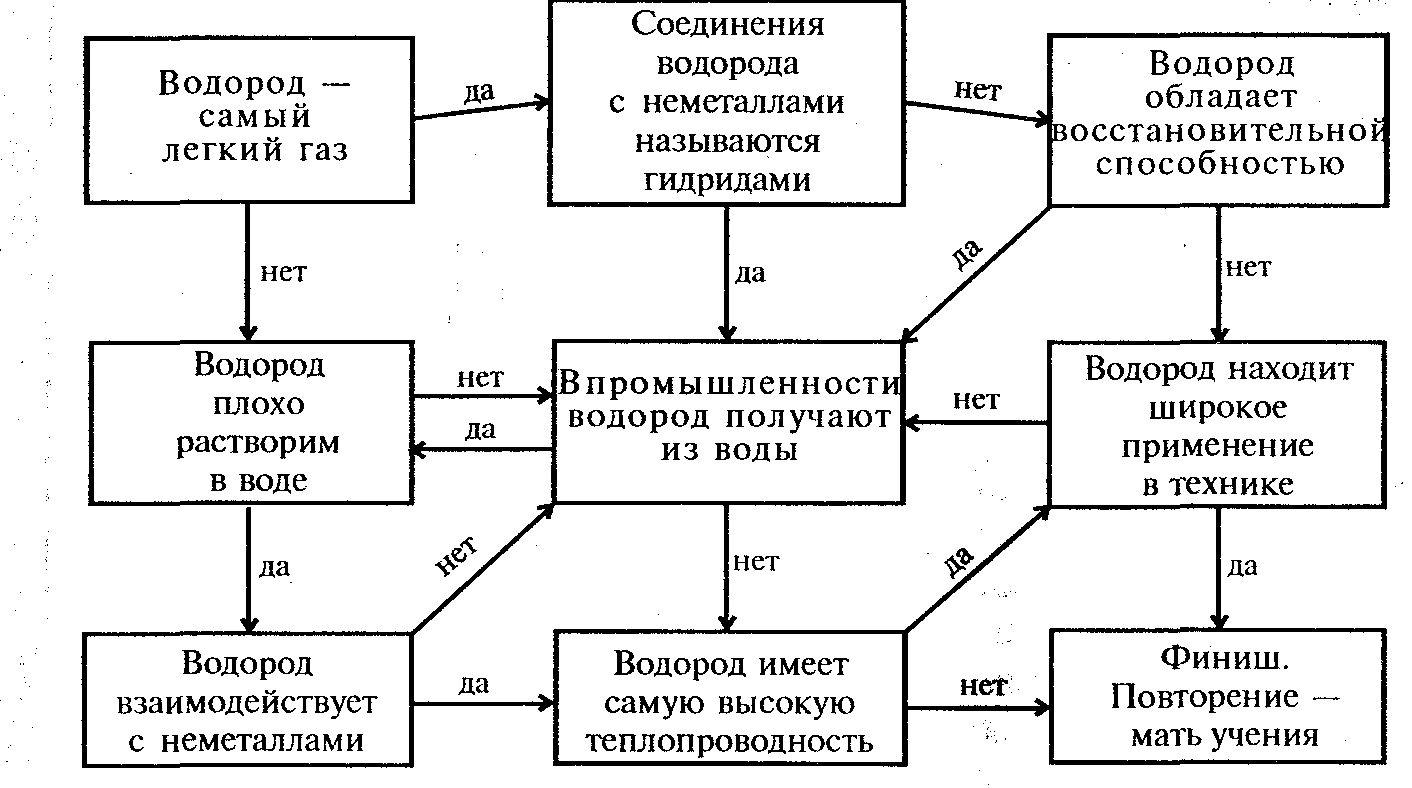
На слайде презентации выведен лабиринт, по которому учащиеся должны пройти и дойти до «выхода». Учитель объясняет правила прохождения: «Найдите путь, который приведет вас к финишу. Начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжаете путь по стрелке с обозначением «да». Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением «нет». Для полного усвоения сведений, приведенных в лабиринте, выбирайте в качестве исходных разные клетки лабиринта».
Рефлексия учащихся, выставление учителем отметок за урок (5 мин.)
Я узнал…
Мне было интересно….
Я запомнил…..
9. Домашнее задание: § 30 зад.7
6


















