Тема: Водородные соединения неметаллов
Обучающая цель: Обобщить знания о водородных соединениях неметаллов на основе знаний о строении атома., показать закономерности в изменении кислотно-основных свойств в зависимости от положения соответствующего химического элемента в ПС, рассмотреть строение водородных соединений неметаллов, закрепить знания об общих и характерных свойствах водородных соединений.
Развивающая цель: развитие внимания, мышления, логики, умения анализировать и делать выводы.
Воспитательная цель: воспитывать интерес к химии.
Принципы обучения: научность, связь теории с практикой, доступность, индивидуальный подход к учащемуся, активизация учебного процесса.
Методы опрос, рассказ, беседа.
Тип урока: изучение нового материала.
Средства обучения: доска, таблицы.
Ход урока
І. Организация работы группы (оглашение темы, цели, плана работы на уроке, заполнение журнала).
ІІ. Проверка домашнего задания.
Опрос по прошлой теме.
ІІІ. Актуализация опорных знаний.
Каков состав водородных соединений, отражаемый химическими формулами по таблице 1.
Таблица 1.
| Группы элементов | I | II | III | IV | V | VI | VII |
|
| R+1H-1 | R+2H-12 | R+3H-13 | R+4H-14 R-4H+14
| R-3H+13 | H+1 2R-2 | H+1 R-1 |
|
| Нелетучие водородные соединения | Летучие водородные соединения |
Вопросы:
Какие водородные соединения вам известны?
Какой тип химической связи в летучих водородных соединениях?
Какую степень окисления проявляет водород в этих соединения?
Как находится степень окисления других неметаллов в этих соединениях?
Почему соединения металлов с водородом нелетучие?
Какой тип химической связи в них?
ІV. Изучение нового материала.

Зависимость свойств водородных соединений от положения неметалла в ПСХЭ.
Водородные соединения HCI и NH3 отличаются по свойствам. От чего это зависит?
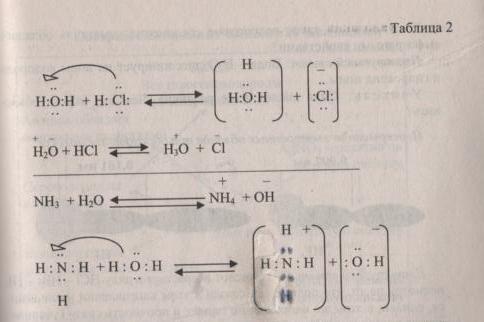
Исходя из того, что связь в водородных соединениях неметаллов ковалентная полярная, данные соединения хорошо растворимы в воде. Хлороводород при растворении в воде образует соляную кислоту. Она диссоциирует следующим образом: вследствие большой полярности связи H—CI, ион водорода со свободной орбиталью присоединяется к кислороду воды. Водород «приносит» свободную орбиталь- акцептор, а кислород располагает на ней пару электронов- донор. В растворе образуются ионы гидроксония- среда кислая, лакмус красный.
Во втором случае азот принимает от воды водород со свободной орбиталью и в растворе остаются гидроксид ионы. Среда раствора основная, лакмус синий.
Это зависит от силы притяжения электронов последнего электронного уровня ядром атома.
Из двух связей N-H и H-O более полярна последняя, поэтому не поделенная электронная связь атома азота легче атакует + поляризованный атом водорода в воде, образуя донорно-акцепторную связь.
В случае хлороводорода: связь H-CI более полярна, чем связь O-H, поэтому здесь атаке подвергается протон хлороводорода.
Влияние водородных соединений неметаллов на здоровье человека.
Мы знаем, что все водородные соединения имеют большое практическое значение для народного хозяйства страны. Они используются в производстве минеральных удобрений, синтезе волокон и пластмасс, лекарственных средств и т.д. Вода – вообще основа жизни на земле. Но сами по себе они чрезвычайно ядовиты!
Соляная кислота
Свободная соляная кислота содержится в желудочном соке и играет важную роль, так как, с одной стороны, способствует перевариванию пищи, с другой стороны - убивает различные болезнетворные бактерии (холеры, чумы и др.). Если последние попадают в желудок вместе с большим количеством воды, то вследствие разбавления раствора соляной кислоты, они выживают и вызывают заболевания организма. Поэтому во время эпидемий особенно опасна сырая вода. При повышенной концентрации соляной кислоты в желудке ощущается «изжога», которую устраняют, принимая во внутрь небольшое количество гидрокарбоната натрия или оксида магния. Наоборот, при недостаточной кислотности желудочного сока, для приема внутрь приписывается разбавленный раствор соляной кислоты.
Содержание в воздухе уже 0,05 мг/л хлороводорода быстро вызывает раздражение в носу и гортани, колотье в груди, хрипоту и ощущение удушья в горле. При хроническом отравлении малыми его концентрациями (порядка 0,01 мг/л) особенно страдают зубы, эмаль которых подвергается более или менее быстрому разрушению.
Сероводород
Ядовитость сероводорода часто недооценивают и работы с ним ведут без соблюдения достаточных мер предосторожности. Между тем уже 0,1% сероводорода в воздухе быстро вызывает тяжелое заболевание. При вдыхании сероводорода в значительных концентрациях. Может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания (если пострадавший не был своевременно удален из отравленной атмосферы). В случае меньших концентраций сероводорода, внезапные обмороки часто наступают лишь через некоторое время после отравления. Тяжело отравленным сероводородом дают вдыхать чистый кислород. При слабой и неправильной работе дыхательных органов приходится применять искусственное дыхание. Хроническое отравление малыми количествами сероводорода обуславливает общее ухудшение самочувствия, исхудание, появление головных болей.
Аммиак
Газообразный аммиак уже при содержании 0,05% его в воздухе очень сильно раздражает слизистые оболочки глаз и дыхательных путей. При остром отравлении им в сильной форме появляются поражения глазных тканей и дыхательных путей, отдышка (вплоть до приступов удушья) и воспаление легких. Средствами первой помощи служат свежий воздух, обильное промывание глаз водой, вдыхание паров. Хроническое отравление аммиаком вызывают упорные катары дыхательного горла и воспаление голосовых связок.
V. Закрепление изученного на уроке.
Какие водородные соединения вам известны?
Какой тип химической связи в летучих водородных соединениях?
Какую степень окисления проявляет водород в этих соединения?
Как находится степень окисления других неметаллов в этих соединениях?
Почему соединения металлов с водородом нелетучие?
Какой тип химической связи в них?
VI. Подведение итогов урока.
Объяснение домашнего задания, оценивание деятельности учащихся.
VII. Домашнее задание.
Выучить конспект. Решить задания в тетради.


















