Обязательный тур (девятый класс задачи)
Задача 9-1.
"...А ты,мой мудрый химик, преданный до страсти
естествоиспытательству, ночами
беззвездными у вытяжного шкафа
мешаешь белый фосфор с мышьяком,
с толченой костью, с серным ангидридом "
Бахыт Кенжеев. "Послания". 1995 г.
К солям, легко дающим при накаливании серный ангидрид, относится железный купорос, т.-е. серножелезистая соль, или соль закиси железа FeSO 4 . Она содержит кристаллизационную воду и при накаливании сперва ее выделяет (хотя последний пай с трудом, как у MgSO4 .7H2O; при дальнейшем накаливании происходит разложение части серного ангидрида закисью железа (SO3 + 2FeO), которая превращается в окись железа Fe2O3, а от этого часть серного ангидрида переходит в сернистый газ. Таким образом, продуктами разложения железного купороса будут: окись железа Fe2O3, сернистый SO2 и серный SO3 ангидриды по уравнению: 2FeSO4 = Fe2O3 + SO2 + SO3. Так как с 2FeSO4 остается еще часть H2O, то в результате получается отчасти гидрат H2SO4 и в нем растворенный ангидрид SO3. Таким образом приготовляли долгое время серную кислоту; это производство было некогда развито около Нордгаузена, почему получающаяся из железного купороса серная кислота носит название дымящей, нордгаузенской кислоты или купоросного масла. В настоящее время дымящую серную кислоту готовят, пропуская летучие продукты разложения купороса в крепкую серную кислоту, приготовленную обыкновенным способом. Сернистый газ в ней не растворяется, а серный ангидрид поглощается. (Д.И.Менделеев "Основы химии" т.2, стр.210.)
Рассчитайте массовую долю (%) серной кислоты, получающуюся при конденсации всех продуктов термического разложения железного купороса (20 оС).
Сколько граммов безводного сульфата железа (II) надо подвергнуть термическому разложению, чтобы 100 г полученной (см. п.1) серной кислоты превратить в 10%-ный олеум.
Рассчитайте максимальную массовую долю (%) соляной кислоты, которую можно получить из серной (см. п.1) добавлением к ней дигидрата хлорида бария.
Задача 9-2.
"...Чтобы стричь воду черную в пороховом ручье, чтобы филин
вещий, словно кукушка, темнолетящий сыч
благословил нас, бедных, круглоглаз и бессилен."
Бахыт Кенжеев
В 1885 г М.Бертло совместно с русским химиком Л.Н.Шишковым исследовали процессы горения дымного пороха и оптимизировали его состав. Ими было установлено, что если содержание калийной селитры в порохе в 4,64 раза превышает содержание серы и угля по массе, а содержание серы в 1,23 раза превышает содержание угля, то при сгорании 1 кг такого пороха выделятся 641 ккал теплоты и образуется 216 л (н.у.) газов.
Рассчитайте состав пороха, предложенного Бертло и Шишковым (масс.%).
Восстановите уравнение горения пороха по Бертло и Шишкову (учтите, что кислород воздуха в этом горении не принимает участия).
Рассчитайте тепловой эффект этой реакции (1 кал = 4,18 Дж).
Классик по поводу артиллерийской стрельбы отмечал: "... и дым багровый клубился к небесам...". Кто и где это написал? Почему "дым багровый" (что в составе дыма может определять окраску)? Почему "клубился к небесам"
Опытные эксперты по запаху ствола (см. детективную литературу) могут определить было ли использовано данное орудие для стрельбы (зарядами на основе дымного пороха) в недавнее время. Что в остатках дымного пороха (нагаре) придает этот запах?
Если бы мы смогли собрать твердые остатки дымного пороха в заметном количестве (нагар), какими химическими реакциями Вы бы могли подтвердить верность предложенного уравнения горения пороха?

Обязательный тур (девятый класс решения)
Задача 9-1.
1.
2FeSO4 .7H2O = Fe2O3 + SO2+ SO3+ 14H2O
SO3 + H2O = H2SO4
Тогда на моль образовавшейся кислоты приходится 13*18 =234 (г) воды. Массовая доля составляет 98:(98+234) = 0,295 или 29,5%.
2. В 100 г раствора полученной кислоты содержится 70,5 г воды (3,9 моль). Для превращения ее в серную требуется 3,9 моль SO3 (312 г). А для образования 10%-ного олеума необходимо еще (100 + 312).0,1/0,9= 45,7 г SO3 (0,57 моль). Всего 4,47 моль SO3. Для получения такого количества SO3 требуется 8,94 моль FeSO4 или 1359 г.
3. Максимальная концентрация хлороводорода соответствует эквимолярному соотношению серной кислоты и хлорида бария:
BaCl2 + H2SO4 = BaSO4+ 2HCl
В 100 г раствора содержится 29,5 г H2SO4 (0,301 моль). Дигидрата хлорида бария прореагирует 0,301 моль ( 73,5 г). Сульфата бария выпадет в осадок 0,301 моль (70,2 г). Хлороводорода получится 0,602 моль (21,9 г). Масса раствора составит 100 + 73,5 - 70.2 = 103,3 (г). Доля хлороводорода в растворе составит 21,9 : 103,3 = 0,212 или 21,2%.
Задача 9-2
1. Содержание калийной селитры (нитрата калия) в порохе составляет: 4,64:(4,64+1) = 0,823 или 82,3%.
Содержание серы и угля, соответственно, составляет 17,7%.
Содержание угля - 17,7:(1,23+1) = 7,94(%).
Содержание серы - 17,7 - 7,94 = 9,76 (%).
2. Молярное соотношение селитры, серы и угля в порохе составляет:
 (KNO3) :
(KNO3) :  (S) :
(S) :  (C) = 82,3/101 : 9,76/32 : 7,94/12 = 0,815 : 0,305 : 0,662 = 2,67:1:2,17 =
(C) = 82,3/101 : 9,76/32 : 7,94/12 = 0,815 : 0,305 : 0,662 = 2,67:1:2,17 =
= 16,02:6:13,02 (округляя до целых чисел, соотношение составит: 16KNO3 + 6S + 13C). Это соотношение можно считать левой частью уравнения горения (исходные вещества).
Можно определить сумму коэффициентов газообразных продуктов горения. Масса исходных веществ составляет 16 *101 + 6 * 32 + 13*12 = 1964 (г).
Объем газообразных продуктов в реакции 216 *1964/1000 = 424 (л); количество газовых продуктов реакции составляет 424/22,4 = 18,9  19 (моль). Основными газовыми продуктами могут быть азот (16 : 2 = 8 (моль в уравнении реакции), оксид углерода (IV) (до 13 моль в уравнении реакции) и оксид серы (IV) (в избытке окислителя). По реакции образуется 19 моль газа, тогда это 8 моль N2 и 11 моль CO2 (остающиеся 2 моль будут в твердом остатке, связанными в K2CO3 – 2 моль). В твердом остатке будет еще 12 моль калия, которые потребуются для связывания серы (как в форме сульфата калия, так и сульфида калия, так как окислителя в смеси недостаточно для перевода всей серы в сульфат). При образовании азота мы должны затратить 16*5 = 80 электронов:
19 (моль). Основными газовыми продуктами могут быть азот (16 : 2 = 8 (моль в уравнении реакции), оксид углерода (IV) (до 13 моль в уравнении реакции) и оксид серы (IV) (в избытке окислителя). По реакции образуется 19 моль газа, тогда это 8 моль N2 и 11 моль CO2 (остающиеся 2 моль будут в твердом остатке, связанными в K2CO3 – 2 моль). В твердом остатке будет еще 12 моль калия, которые потребуются для связывания серы (как в форме сульфата калия, так и сульфида калия, так как окислителя в смеси недостаточно для перевода всей серы в сульфат). При образовании азота мы должны затратить 16*5 = 80 электронов:
N+5 + 5 e = N0, при окислении углерода можно освободить 13*4 = 52 электрона:
C0 - 4e = C+4,
еще 28 электронов должно быть образовано в реакциях серы. При окислении всей серы до сульфата образовалось бы 6*6 = 36 электронов, то есть не вся сера образует сульфат, а только пять моль и при этом образуется моль сульфида калия (6*5 =30; 30-2 = 28, что вполне соответствует электронному балансу).
К аналогичному выводу можно прийти, исходя из материального баланса кислорода. Из исходных 48 моль атомов кислорода нитрата калия в газовой фазе будут 22 моль атомов в CO2, 6 моль атомов кислорода будут в твердом остатке в составе карбоната калия, тогда на образование сульфата остается 48 -22 - 6 = 20; 20 : 4 = 5 - моль сульфата калия образуется в реакции. По балансу калия и серы можно определить, что еще может образоваться 1 моль сульфида калия. Уравнение Бертло имеет вид:
16KNO3 + 6S + 13C = 5K2SO4 + K2S + 2K2CO3 + 11CO2 + 8N2
3. Масса исходных веществ составляет 16*101 + 6* 32 + 13*12 = 1964 (г).
Тогда тепловой эффект реакции составляет 641 * 1,964 = 1259 (ккал) или 1259 *,18 =5262 кДж.
4. А.С.Пушкин, "Полтава".
Окраска определяется присутствием калия (паров) в составе пороховых газов (так же как соли калия окрашивают пламя, только в гораздо большей концентрации из-за высокой температуры). Дым - результат конденсации твердых продуктов горения пороха (сам по себе белый). Поднимался вверх за счет высокой температуры продуктов при экзотермической реакции.
5. “Нагар” - твердые остатки продуктов реакции горения пороха. Заметным запахом обладает только сульфид калия. Запах сероводорода, который образуется в результате гидролиза сульфида (или взаимодействия с углекислым газом воздуха):
K2S + H2O  KHS + KOH
KHS + KOH
KHS + H2O  KOH + H2S
KOH + H2S
6. Твердый остаток - K2SO4, K2CO3, K2 S. Для доказательства их присутствия в твердом остатке продукты горения можно растворить в воде. К полученному раствору прилить избыток раствора нитрата бария, образующийся белый осадок может содержать сульфат и карбонат бария. Сульфид остается в растворе, и после отделения осадка может быть обнаружен при действии нитрата свинца, или нитрата меди по образованию черного осадка сульфидов свинца (меди):
K2SO4 + Ba(NO3)2 = BaSO4  + 2KNO3
+ 2KNO3
K2CO3 + Ba(NO3)2 = BaCO3  + 2KNO3
+ 2KNO3
K2S + Pb(NO3)2 = PbS  + 2 KNO3
+ 2 KNO3
Полученный осадок (после фильтрования или декантации) можно обработать раствором соляной кислоты, выделение газа свидетельствует о присутствии карбоната, а остающийся нерастворимым осадок в соляной кислоте - о наличии сульфата:
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
+ H2O
бязательный тур (десятый класс задачи)
Задача 10-1
Белый нерадиоактивный порошок А массой 1,00 г нагрели до 500o С. Среди газообразных продуктов реакции содержался NO2, а в твердом остатке оказалось 0,63 г темно-серого порошка. Никаких продуктов, жидких при 40o С, не образовалось.
Что мог представлять собой порошок А в предположении, что это индивидуальное соединение, а точность взвешивания  0,01 г. Напишите уравнение реакции его разложения при нагревании.
0,01 г. Напишите уравнение реакции его разложения при нагревании.
Задача 10-2
Однажды, 30 ноября 1825 г., молодой французский ученый, препаратор университета в г. Монпелье, направил письмо в Парижскую Академию наук, в котором он сообщил об открытии нового элемента, названного им мурием. Этот мурий был выделен из осадка, кристаллизующегося из маточника после отделения природной поваренной соли. Этот же элемент был выделен и из золы некоторых морских водорослей. Академия признала факт открытия нового элемента, однако название его было изменено. Интересно, что за несколько лет до этих событий этот новый элемент буквально "держал в руках" великий Юстус Либих, однако он так и не понял, с чем имел дело. В 1826 г. Ю.Либих выразился по этому поводу: "Это не … открыл …, а … открыл для нас …!".
Массовая доля этого элемента в четырех бинарных соединениях составляет 83,3%; 96,4%; 88,6%; 71,4%. Плотность этих соединений, находящихся в газообразном состоянии, по водороду равна 96, 166, 135,5 и 112, соответственно.
Каково современное название этого элемента? Что оно означает? Почему не подошло название "мурий"?
Кто открыл этот элемент? Приведите полностью знаменитую фразу Ю.Либиха. За какое соединение принял Либих этот элемент?
Что за бинарные соединения упомянуты в задаче? Установите состав и пространственное строение их молекул.

Обязательный тур (десятый класс решения)
Задача 10-1
Индивидуальное соединение, при нагревании которого выделяется NO2 может быть нитратом либо нитритом металла. Поскольку жидких продуктов не образовалось, это не кристаллогидрат. При его нагревании могут образовываться либо оксид металла, либо чистый металл. Оценим эквивалентную массу металла M(M)/n (n – его валентность) для всех случаев.
Случай 1. Исходное вещество - нитрат, при нагревании образуется металл.
M(M)/M(M(NO3)n) = 0,63/1,00
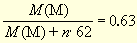
 ,
,
откуда M(M)/n = 105,6. Такого металла нет. Но взвешивание произведено с погрешностью, поэтому необходимо оценить диапазон эквивалентной массы металла. Максимальной она будет, если масса исходного вещества окажется 0,99 г (нижний предел истинной массы) при массе продукта 0,64 г (верхний предел истинной массы). Тогда соотношение в правой части уравнения становится равным 0,646, а M(M)/n = 113. Минимальной она будет, если масса исходного вещества окажется 1,01 г (верхний предел истинной массы) при массе продукта 0,62 г (нижний предел истинной массы). Тогда соотношение в правой части уравнения становится равным 0,614, а M(M)/n = 98,5. То есть, с учетом погрешности взвешивания эквивалентная масса металла лежит в диапазоне 98-113. В этот диапазон укладывается серебро с эквивалентной массой 107.
2AgNO3 = 2Ag + 2NO2 + O2.
Случай 2. Исходное вещество - нитрат, при нагревании образуется оксид металла в той же степени окисления. Для нахождения минимальной эквивалентной массы
M(MOn/2)/M(M(NO3)n) = 0,62/1,01
 ,
,
откуда M(M)/n = 77,8. Аналогично максимальная оценка дает M(M)/n = 90,7. Металлов с такими эквивалентными массами, разлагающихся до оксидов без изменения степени окисления металла и при этом не радиоактивных, нет.
Случай 3. Исходное вещество - нитрит, при нагревании образуется металл. Для нахождения минимальной эквивалентной массы
M(M)/M(M(NO2)n) = 0,62/1,01
 ,
,
откуда M(M)/n = 73. Аналогично максимальная оценка дает M(M)/n = 84. Металлов с такими эквивалентными массами, нитриты которых разлагались бы с образованием металла, нет.
Случай 4. Исходное вещество - нитрит, при нагревании образуется оксид металла в той же степени окисления. Для нахождения минимальной эквивалентной массы
M(MOn/2)/M(M(NO2)n) = 0,62/1,01
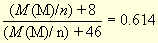
откуда M(M)/n = 52,4. Аналогично максимальная оценка дает M(M)/n = 61,5. Под все условия задачи ни один металл не подходит (Cd и РЗМ, подходящие по химическим свойствам, не образуют темно-серых оксидов).
Кроме четырех рассмотренных случаев возможны нитраты металлов, разлагающиеся с повышением степени окисления металла. К таким нитратам относятся, в частности, CuNO3, Mn(NO3)2. Так же ведут себя Fe(NO3)2 и Ce(NO3)3, но образующиеся при этом оксиды не имеют темно-серой окраски. Проверим первые два соединения на соответствие условиям задачи.
CuNO3 = CuO + NO2
M(CuO)/M(CuNO3) = 80/126 = 0,635, что вполне укладывается в диапазон 0,614 ч 0,646, получаемый с учетом погрешностей при взвешивании. То есть CuNO3 вполне может быть исходным соединением.
Mn(NO3)2 = MnO2 + 2NO2
M(MnO2)/M(Mn(NO3)2) = 87/179 = 0,486, что не укладывается в диапазон 0,614-0,646. То есть Mn(NO3)2 не может быть исходным соединением.
Таким образом, порошок А - либо AgNO3, либо CuNO3.
Задача 10-2
Бром (от греческого "бромос" – зловонный). Название "мурий" не прижилось, т.к. муриевой кислотой (acidum muriaticum) называли соляную кислоту, из которой был получен в свое время хлор (т.е. название не приняли во избежание путаницы хлора и брома).
А. Балар. Цитата Ю. Либиха "Это не Балар открыл бром, а бром открыл для нас Балара!" ICl – имеет близкую молярную массу.
Кто не знает историю химии, то "выйти" на бром можно при ответе на этот вопрос.

Обязательный тур (одиннадцатый класс задачи)
Задача 11-1
Элемент X образует ряд бинарных соединений с кислородом:
| Соединение | Y1 | Y2 | Y3 | Y4 | Y5 |
|  % кислорода % кислорода
| 57.1 | 72.7 | 62.5 | 50.0 | 47.1 |
Эти соединения можно получить следующим образом:
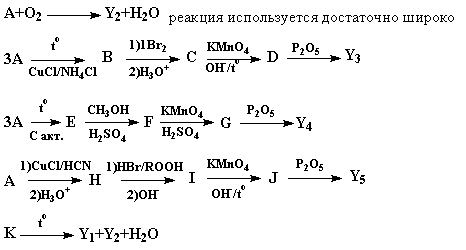
Вопросы:
1. Определите вещества Y1-Y5, A-K, элемент X. Напишите уравнения реакций.
2. Опишите пространственное строение молекул Y1-Y5 и назовите эти вещества.
Задача 11-2
Два изомерных углеводорода А и В содержат 93,7% углерода по массе. Углеводород А – бесцветное кристаллическое соединение, которое под действием концентрированной азотной кислоты на холоду образует мононитросоединение С, а при действии нитрующей смеси – динитропроизводное D, содержащее 12,84% азота. Второй углеводород B – ярко окрашенное, также кристаллическое вещество, которое под действием как холодной азотной кислоты, так и нитрующей смеси меняет окраску, а при разбавлении водой возвращается в неизменном виде. Однако при обработке В ацетилнитратом или нитратом меди в органических растворителях можно получить его азотсодержащее производное Е, изомерное C.
Вопросы:
1. Установите структурные формулы соединений A, B, C, D и E, ответ подтвердите расчетами.
2. Объясните выбор вами структуры E.
3. Объясните, почему соединение В не образует нитропроизводных при реакциях с кислотами. Изобразите структуру, которая образуется при обработке В кислотами.
Обязательный тур (одиннадцатый класс решения)
Задача 11-1
Определим элемент X.
Пусть состав Y2 = X2On (в Y2 больше всего  (O)) , тогда
(O)) , тогда  ,откуда M(X)=3,0n. Подходит только n=4, X-углерод.
,откуда M(X)=3,0n. Подходит только n=4, X-углерод.
Тогда:
| Соединение | Y1 | Y2 | Y3 | Y4 | Y5 |
| Простейшая формула | CO | CO2 | C4O5 | C4O3 | C3O2 |
Очевидно, что вещество A (реакция сгорания которого используется довольно широко и которое способно тримеризоваться различными способами) – ацетилен.

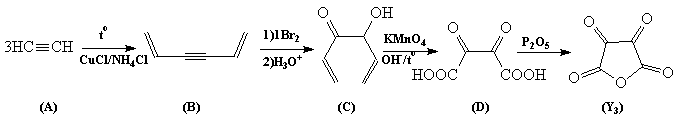

Y1- CO – линейное строение / моноокись углерода
Y2- CO2 – линейное строение / двуокись углерода
Y3- C4O5 – плоское строение / ангидрид диоксоянтарной кислоты
Y4- C12O9 – плоское строение / ангидрид мелитовой кислоты
Y5- C3O2 – линейное строение / недоокись углерода
Задача 11-2
Углеводороды А и В имеют формулу СxHy, тогда n(С):n(H) = 93,7/12:6,3/1 = 1,24:1  5:4, т.е. простейшая формула не удовлетворяет описанным в условии задачи превращениям. Удвоение формулы приводит к соединению С10Н8. Для одного из изомеров (А) можно предложить структуру нафталина. Это подтверждается тем, что на холоду нафталин действительно нитруется азотной кислотой с образованием мононитропроизводного (С), а в более жестких условиях (нитрующая смесь) - динитропроизводного (D), в котором содержание азота действительно составляет 12,84%. Введение первой нитрогруппы дезактивирует бензольное кольцо, и вторая группа вступает в незамещенное кольцо с образованием преимущественно 1,5-динитронафталина.
5:4, т.е. простейшая формула не удовлетворяет описанным в условии задачи превращениям. Удвоение формулы приводит к соединению С10Н8. Для одного из изомеров (А) можно предложить структуру нафталина. Это подтверждается тем, что на холоду нафталин действительно нитруется азотной кислотой с образованием мононитропроизводного (С), а в более жестких условиях (нитрующая смесь) - динитропроизводного (D), в котором содержание азота действительно составляет 12,84%. Введение первой нитрогруппы дезактивирует бензольное кольцо, и вторая группа вступает в незамещенное кольцо с образованием преимущественно 1,5-динитронафталина.
Возможность получения продуктов замещения (соединение Е - изомер С) позволяет предположить для В также ароматическую структуру. Однако гораздо более мягкие условия ароматического замещения допускают предположение, что ароматичность обеспечивается не бензольными кольцами, а скорее полностью сопряженной системой конденсированных пяти- и семичленных колец. (структура В1). В случае полного переноса заряда из семичленного кольца в пятичленное (структура В2) возникает комбинация двух ароматических систем - циклопентадиенил-аниона и катиона тропилия. Этот углеводород называется азуленом. Под действием сильных кислот протонирование азулена протекает по несущему частичный отрицательный заряд пятичленному кольцу (по нему же направляется атака электрофила при ароматическом замещении) с образованием мезомерного иона ВН+. При разбавлении водой депротонирование ВН+ приводит снова к азулену.
Нитрование - реакция электрофильного замещения, и при действии мягких нитрующих агентов в апротонной среде происходит образование нитроазулена (Е).