Лекция Химия
Тема: Металлы – простые вещества
План
1. Особенности строения атомов металлов.
2. Способы получения металлов.
3. Физические свойства металлов.
4. Химические свойства металлов.
1. Особенности строения атомов металлов
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s-элементы I и II групп (исключение — водород), все d- и f - элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
сравнительно слабая связь валентных электронов с ядром;
низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. металлы - восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
 Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Men+ + пе- = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
2. Способы получения металлов
| Пирометаллургия — восстановление безводных соединений при высокой температуре |
| Восстановители |  Примеры Примеры
| Получаемые металлы |
| С или СО (карботермия)
| PbO + C = Pb + CO Fe203 + 3СО = 2Fe + 3C02 Сульфиды предварительно обжигают:  2ZnS + 302 = 2ZnO + 2S02 2ZnS + 302 = 2ZnO + 2S02
ZnO + С = Zn + 2СО | Fe, Cu, Pb, Sn, Cd, Zn
|
| Al, Mg и др. (металлотермия) | Cr203 + 2AI = 2Cr + Al203 TiCI4 + 2Mg = Ti + 2MgCl2 | Mn, Cr, W, Mo, Ti, V
|
| H2(водородотермия) | Mo03 + 3H2 = Mo + 3H20 Оксиды активных металлов (МgО, СаО, А1203 и др.) водородом не восстанавливаются | Cu, Ni, W, Fe, Mo, Cd, Pb
|
| Электрометаллургия – восстановление электрическим током |
| Виды электролиза | Примеры | Получаемые металлы |
| Электролиз расплавов | NaCl = Na+ + Cl- расплав  К Na+ + е- = Na 2 К Na+ + е- = Na 2
 А Cl- + 2е- = Cl2 1 А Cl- + 2е- = Cl2 1
 2NaCl электролиз 2Na + Cl2 2NaCl электролиз 2Na + Cl2
2Al2O3 электролиз 4Al + 3O2 Na3(AlF6) | Щелочные металлы, Be, Mg, Ca (из расплавленных хлоридов), Al – из расплавленного оксида |
| Электролиз растворов | NiSO4 = Ni2+ + SO42- раствор К Ni2+ + 2е- = Ni 2   А 2Н2О - 4е- = O2 + 4Н+ 1 А 2Н2О - 4е- = O2 + 4Н+ 1
 2NiSO4 + 2Н2О электролиз 2Ni + О2 + Н2SO4 2NiSO4 + 2Н2О электролиз 2Ni + О2 + Н2SO4
| Zn, Cd, Co, Mn, Fe |
| Гидрометаллургия – восстановление из растворов солей |
| Примеры | Получаемые металлы |
| Металл, входящий в состав руды, переводят в раствор, затем восстанавливают более активным металлом: CuO + H2SO4 = CuSO4 + H2O CuSO4 + Fe = FeSO4 + Cu CdO + H2SO4 = CdSO4 + H2O CdSO4 + Zn = ZnSO4 + Cd | Cd, Ag, Au, Cu |
Задания для самостоятельной работы
1. Атому магния в степени окисления +2 соответствует электронная конфигурация:
а) 1s2 2s2 2р6 3s2 3р6; в) 1s2 2s2 2р4;
б) 1s2 2s2 2р6; г) 1s2 2s2 2р6 3s2;
2. При частичном восстановлении водородом 30 г оксида кобальта. В получили смесь оксида и металла массой 26,8 г. Определите количество вещества водорода, вступившего в реакцию, и массовую долю кобальта в полученной смеси.
3. При электролизе раствора сульфата меди (II) в растворе образовалась кислота (около анода), на нейтрализацию которой затрачен раствор объемом 16 см (р = 1,05 г/см3) с массовой долей гидроксида калия 6%. Вычислите массу меди, которая выделилась на катоде.
4. Для восстановления марганца из оксида марганца(1\/) путем алюмотермии было смешано 10,8 г алюминия и 26,2 г оксида. Определите, какое из исходных веществ осталось и какова его масса.
3. Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1). Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блеск и непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см3): Na, Са, Mg, Al, Ti — и тяжелые (плотность больше 5 г/см3): Zn, Cr, Sn, Mn, Ni, Сu, Ag, Pb, Hg, Аи, W, Os - самый тяжелый;
2). по значению температуры плавления — на легкоплавкие (tпл Hg, Na, Sn, Pb, Zn, Mg, Al, Ca, Ag — и тугоплавкие (tпл 1000 °C): Au, Cu, Mn, Ni, Fe, Ti, Cr, Os, W - самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей (Fe, Со, Ni);
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях (Al, Cr, Ti);
в) диамагнитные — не притягиваются к магниту (Sn, Сu, Bi).
4. Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me - пе- = Meп+(окисление)
восстановитель
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
1). Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
2Mg + 02 = 2MgO 4А1 + 302 = 2А1203
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
4Li + 02 = 2Li20
оксид лития
Основной продукт окисления натрия — пероксид:
2Na + 02 = Na202
пероксид
натрия
При горении других щелочных металлов образуются супероксиды, например:
+1 -1 0 0 -1 +1
2К + 202 = К204 ( К-О-О-О-О—К)
супероксид
калия
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
Na202 + 2Na = 2Na20
На реакции пероксида натрия с оксидом углерода (1V) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
2Na2О2 + 2СО2 = 2Na2CО3 + О2
При нагревании металлы реагируют с другими неметаллами:
| Mg + Br2 = MgBr2 | 4А1 + 3С = А14С3 |
| бромид | карбид |
| магния | алюминия |
| 2А1 + N2 = 2A1N | 3Fe + С = Fe3C |
| нитрид | карбид |
| алюминия | железа |
| 3Са + 2Р = Са3Р2 | Са + 2С = СаС2 |
| фосфид | карбид |
| кальция | кальция |
| Сu + S = CuS | 2Mg + Si = Mg2Si |
| сульфид | силицид |
|
|
|
меди (II) магния
Если металл проявляет переменную степень окисления, то активные неметаллы (фтор, хлор, бром, кислород) окисляют его до более высокой степени окисления, в которой он образует устойчивое в данных условиях соединение, а менее активные — до более низкой степени окисления. Так, железо проявляет в соединениях степени окисления +2 и +3 (иногда +6), из них +3 наиболее устойчива. В связи с этим при взаимодействии железа с хлором, бромом оно окисляется до степени окисления +3, а при взаимодействии с серой или иодом — до степени окисления +2:
2Fe + ЗС12 = 2 FeCl3 Fe + S = FeS
Щелочные и щелочно-земельные металлы при нагревании вступают в реакцию с водородом, образуя гидриды. Атомы водорода в данных соединениях имеют отрицательную степень окисления:
2Na + Н2 = 2NaH Ва + Н2 = BaH2
гидрид гидрид
натрия бария
Гидриды представляют собой кристаллические тугоплавкие солеобразные вещества белого цвета. Они активные восстановители за счет водорода в минимальной степени окисления (-1). Так, гидриды горят в атмосфере хлора, кислорода, энергично разлагаются водой с образованием щелочи и выделением водорода:
 КН + С12 = КС1 + НС1 СаН2 + 02 = Са(ОН)2
КН + С12 = КС1 + НС1 СаН2 + 02 = Са(ОН)2
ВаН2 + 2Н20 = Ва(ОН)2 + 2Н2
Гидриды применяют для получения водорода в полевых условиях (для водородной сварки), восстановления металлов из их оксидов, а также в органическом синтезе.
2). Взаимодействие металлов со сложными веществами
Если химические реакции протекают в водных растворах, то восстановительная активность металла определяется его положением в электрохимическом ряду напряжений.
А). Взаимодействие с водой
 С водой при обычной температуре реагируют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды) и гидроксиды которых растворимы в воде (на поверхности металла не образуется защитная пленка). К таким металлам относятся щелочные и щелочно-земельные металлы:
С водой при обычной температуре реагируют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды) и гидроксиды которых растворимы в воде (на поверхности металла не образуется защитная пленка). К таким металлам относятся щелочные и щелочно-земельные металлы:
 2Na + 2Н20 = 2NaOH + Н2
2Na + 2Н20 = 2NaOH + Н2
 Fe + Н20 (так как Fe(OH)2 нерастворим в воде)
Fe + Н20 (так как Fe(OH)2 нерастворим в воде)
При нагревании с водой или парами воды взаимодействуют металлы от магния до олова. Реакция протекает с образование» гидроксидов или оксидов и выделением водорода:

 Mg + 2Н20 = Mg(OH)2 + Н2 3Fe + 4Н20 = Fe304 + 4H2
Mg + 2Н20 = Mg(OH)2 + Н2 3Fe + 4Н20 = Fe304 + 4H2
Б). Взаимодействие с щелочами
С растворами щелочей взаимодействуют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды), а их оксиды и гидроксиды амфотерны (оксидные и гидроксидные пленки растворяются в растворе щелочи). К таким металлам относятся цинк, алюминий, олово, бериллий, свинец и некоторые другие. Процесс протекает в три стадии:
1) растворение в щелочи пленки амфотерного оксида, которая покрывает поверхность металла;
2) взаимодействие металла, освобожденного от защитной оксидной пленки, с водой с образованием нерастворимого амфотерного гидроксида;
3) растворение образовавшейся пленки гидроксида в растворе щелочи.
Рассмотрим пример:
А1203 + 2NaOH + ЗН20 = 2Na[Al(OH)4]
амфотерный

 2А1 + 6Н20 = 2А1(0Н)3 + ЗН2
2А1 + 6Н20 = 2А1(0Н)3 + ЗН2
амфотерный
2А1(ОН)3 + 2NaOH = 2Na[Al(OH)4)
амфотерный
(В результате второй реакции образовалось 2 моль А1(ОН)3, поэтому в уравнении третьей реакции записываем тоже 2 моль А1(ОН)3.)
 Если просуммировать два последних уравнения, то получим уравнение реакции алюминия с раствором щелочи:
Если просуммировать два последних уравнения, то получим уравнение реакции алюминия с раствором щелочи:
2А1 + 2NaOH + 6Н20 = 2Na[Al(OH)4) + ЗН2
Таким образом, при взаимодействии металла с раствором щелочи роль последней сводится к снятию с поверхности металла оксидной и гидроксидной пленки, а металл взаимодействует с водой.
 Эти же металлы реагируют со щелочами при нагревании:
Эти же металлы реагируют со щелочами при нагревании:
Zn + 2NaOH = Na2Zn02 + Н2
тв.
Металлы, высшие оксиды которых обладают амфотерными или кислотными свойствами, реагируют с щелочными расплава ми окислителей. В качестве окислителей используют нитраты калия или натрия, хлорат калия и др.
При взаимодействии с щелочными расплавами окислителей металлы образуют соли анионного типа, в которых, как правило, проявляют высшую степень окисления, например: +6
Fe + 3KN03 + 2КОН = K2Fe04 + 3KN02 + Н20
феррат калия
Аналогичные продукты образуются и при взаимодействии щелочных расплавов окислителей с оксидами металлов, в которых металлы проявляют промежуточную степень окисления: +3 +6
Fe203 + КСЮ3 + 4КОН = 2K2Fe04 + КС1 + 2Н20
В). Взаимодействие с кислотами
С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода (разбавленная серная, фосфорная, сернистая, все бескислородные и органические кислоты и др.), реагируют металлы:
расположенные в ряду напряжений до водорода (эти металлы способны вытеснять водород из кислоты);
образующие с этими кислотами растворимые соли (на поверхности этих металлов не образуется защитная солевая пленка).

 В результате реакции образуются растворимые соли и выделяется водород:
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НС1 = 2А1С13 + 3Н2 Mg + H2S04 = MgS04 + H2
 разб.
разб.
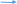 Сu + H2S04 (так как Сu стоит после Н2)
Сu + H2S04 (так как Сu стоит после Н2)
разб.
Pb + H2S04 (так как PbS04 нерастворим в воде)
разб.
С кислотами-окислителями — азотной и концентрированной серной, которые, как вам известно, проявляют окислительные свойства за счет атомов серы и азота в высших степенях окисления, взаимодействуют практически все металлы, расположенные в ряду напряжений как до, так и после водорода, кроме золота и платины. Так как окислителями в этих кислотах являются ионы кислотных остатков, а не ионы водорода, то прн их взаимодействии с металлами не выделяется водород. Металл под действием данных кислот окисляется до характерной (устойчивой) степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и от степени разбавления кислоты.
Г). Взаимодействие металлов с кислотами-окислителями -2
 активный металл Li — Zn Соль + H2S + Н20
активный металл Li — Zn Соль + H2S + Н20
 +6 0
+6 0


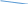 H2S04 (конц.) металл средней активности Cd — Pb Соль + S + Н20
H2S04 (конц.) металл средней активности Cd — Pb Соль + S + Н20
+4
неактивный металл (после Н2) Соль + S02 + Н20
 и Fe (при нагревании)
и Fe (при нагревании)
+4
 HNO3((конц.) независимо от активности металла Соль + N02 + Н20
HNO3((конц.) независимо от активности металла Соль + N02 + Н20
0
 активный металл Li — Zn Соль + N2 + Н20
активный металл Li — Zn Соль + N2 + Н20
 +1
+1
 HN03 (разб.) металл средней активности Fe — Pb Соль + N2O + Н20
HN03 (разб.) металл средней активности Fe — Pb Соль + N2O + Н20
 +4
+4
неактивный металл (после Н2) Соль + N0 + Н20
 и Fe (при нагревании)
и Fe (при нагревании)
-3
 HN03 (оч. разб.) активный металл Соль+ NH4N03 + H20
HN03 (оч. разб.) активный металл Соль+ NH4N03 + H20
На основании схемы составим уравнения реакций меди и магния с концентрированной серной кислотой:

 0 +6 +2 +4 0 +6 +2 -2
0 +6 +2 +4 0 +6 +2 -2
Сu+ 2H2S04 = CuS04 + S02 + 2Н20 4Mg + 5H2S04 = 4MgS04 + H2S + 4H20
kонц. kонц.
Следует иметь в виду, что на схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот. Так, при взаимодействии серной кислоты с цинком или магнием в зависимости от концентрации кислоты могут образоваться различные продукты восстановления серной кислоты:
 Zn + 2H2S04 = ZnS04 + S02 + 2H20
Zn + 2H2S04 = ZnS04 + S02 + 2H20
70%-ная
 3Zn + 4H2S04 = 3ZnS04 + S + 4H20
3Zn + 4H2S04 = 3ZnS04 + S + 4H20
40% -ная
 4Zn + 5H2S04 = 4ZnS04 + H2S + 4H20
4Zn + 5H2S04 = 4ZnS04 + H2S + 4H20
25% -ная
Восстановление серной кислоты до сероводорода может протекать в растворе с массовой долей кислоты 25% и выше (если массовая доля серной кислоты ниже 25% , то она считается разбавленной). Однако по мере повышения концентрации кислоты возможность образования сероводорода уменьшается, так как при этом окислительные свойства серной кислоты усиливаются, а сероводород — активный восстановитель за счет атома серы в минимальной степени окисления (H2S). Поэтому концентрированная серная кислота окислит его до серы или до сернистого газа:
-2 +6 0
3H2S + H2S04 = 4S + 4Н20 (менее концентрированная H2S04)
-2 +6 +4
Н2S + 3H2S04 = 4S02 + 4H20 (более концентрированная H2S04)
Степень восстановления азотной кислоты при взаимодействии с одним и тем же металлом, например магнием или цинком, также определяется ее концентрацией. Концентрированная кислота восстанавливается до оксида азота (IV), так как низшие оксиды, образованные в ходе реакции, окисляются кислотой. По мере ее разбавления возрастает возможность образования продукта наиболее полного восстановления:

Mg + 4HN03 = Mg(N03)2 + 2N02 + 2H20
 60% -ная
60% -ная
3Mg + 8HN03 = 3Mg(NOg)2 + 2NO + 4H20
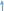 30% -ная
30% -ная
4Mg + 10HN03 = 4Mg(N03)2 + N20 + 5H20
20% -ная
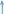 5Mg + 12HN03 = 5Mg(N03)2 + N2 + 6H20
5Mg + 12HN03 = 5Mg(N03)2 + N2 + 6H20
10% -ная
4Mg + 10HN03 = 4Mg(N03)2 + NH4N03 + 3H20
3% -ная
Некоторые металлы (железо, алюминий, хром) не взаимодействуют с концентрированной серной и азотной кислотами при обычной температуре, так как происходит пассивация металла. Это явление связано с образованием на поверхности металла тонкой, но очень плотной оксидной пленки, которая и защищает металл. По этой причине концентрированную азотную и серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, проявляющими окислительные свойства за счет ионов Н+, он образует соли, в которых его степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых он проявляет более устойчивую степень окисления:
 0 +2
0 +2
Fe + H2S04 = FeS04 + H2
разб.
 0 +3
0 +3
2Fe + 6H2S04 = Fe2(S04)3 + 3S02 + 6H20
конц.
Д).Взаимодействие с растворами солей
Каждый металл, начиная с магния, вытесняет все следующие за ним в ряду напряжений металлы из растворов их солей:
Fe + CuS04 = FeS04 + Сu
Такие металлы, как литий, натрий, калий, кальций, барий. использовать для вытеснения менее активных металлов из водных растворов солей нельзя, так как при обычных условиях они реагируют с водой.







 Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu Примеры
Примеры 2ZnS + 302 = 2ZnO + 2S02
2ZnS + 302 = 2ZnO + 2S02  К Na+ + е- = Na 2
К Na+ + е- = Na 2 А Cl- + 2е- = Cl2 1
А Cl- + 2е- = Cl2 1 2NaCl электролиз 2Na + Cl2
2NaCl электролиз 2Na + Cl2
 А 2Н2О - 4е- = O2 + 4Н+ 1
А 2Н2О - 4е- = O2 + 4Н+ 1 2NiSO4 + 2Н2О электролиз 2Ni + О2 + Н2SO4
2NiSO4 + 2Н2О электролиз 2Ni + О2 + Н2SO4 КН + С12 = КС1 + НС1 СаН2 + 02 = Са(ОН)2
КН + С12 = КС1 + НС1 СаН2 + 02 = Са(ОН)2  С водой при обычной температуре реагируют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды) и гидроксиды которых растворимы в воде (на поверхности металла не образуется защитная пленка). К таким металлам относятся щелочные и щелочно-земельные металлы:
С водой при обычной температуре реагируют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды) и гидроксиды которых растворимы в воде (на поверхности металла не образуется защитная пленка). К таким металлам относятся щелочные и щелочно-земельные металлы: 2Na + 2Н20 = 2NaOH + Н2
2Na + 2Н20 = 2NaOH + Н2  Fe + Н20 (так как Fe(OH)2 нерастворим в воде)
Fe + Н20 (так как Fe(OH)2 нерастворим в воде)
 Mg + 2Н20 = Mg(OH)2 + Н2 3Fe + 4Н20 = Fe304 + 4H2
Mg + 2Н20 = Mg(OH)2 + Н2 3Fe + 4Н20 = Fe304 + 4H2
 2А1 + 6Н20 = 2А1(0Н)3 + ЗН2
2А1 + 6Н20 = 2А1(0Н)3 + ЗН2 Если просуммировать два последних уравнения, то получим уравнение реакции алюминия с раствором щелочи:
Если просуммировать два последних уравнения, то получим уравнение реакции алюминия с раствором щелочи: Эти же металлы реагируют со щелочами при нагревании:
Эти же металлы реагируют со щелочами при нагревании: В результате реакции образуются растворимые соли и выделяется водород:
В результате реакции образуются растворимые соли и выделяется водород: разб.
разб. Сu + H2S04 (так как Сu стоит после Н2)
Сu + H2S04 (так как Сu стоит после Н2) активный металл Li — Zn Соль + H2S + Н20
активный металл Li — Zn Соль + H2S + Н20 +6 0
+6 0
 H2S04 (конц.) металл средней активности Cd — Pb Соль + S + Н20
H2S04 (конц.) металл средней активности Cd — Pb Соль + S + Н20 и Fe (при нагревании)
и Fe (при нагревании)  HNO3((конц.) независимо от активности металла Соль + N02 + Н20
HNO3((конц.) независимо от активности металла Соль + N02 + Н20 активный металл Li — Zn Соль + N2 + Н20
активный металл Li — Zn Соль + N2 + Н20 +1
+1 HN03 (разб.) металл средней активности Fe — Pb Соль + N2O + Н20
HN03 (разб.) металл средней активности Fe — Pb Соль + N2O + Н20 +4
+4 и Fe (при нагревании)
и Fe (при нагревании)  HN03 (оч. разб.) активный металл Соль+ NH4N03 + H20
HN03 (оч. разб.) активный металл Соль+ NH4N03 + H20 0 +6 +2 +4 0 +6 +2 -2
0 +6 +2 +4 0 +6 +2 -2  3Zn + 4H2S04 = 3ZnS04 + S + 4H20
3Zn + 4H2S04 = 3ZnS04 + S + 4H20 4Zn + 5H2S04 = 4ZnS04 + H2S + 4H20
4Zn + 5H2S04 = 4ZnS04 + H2S + 4H20
 60% -ная
60% -ная 5Mg + 12HN03 = 5Mg(N03)2 + N2 + 6H20
5Mg + 12HN03 = 5Mg(N03)2 + N2 + 6H20 0 +2
0 +2









