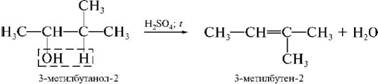Департамент здравоохранения Брянской области
ГАПОУ «Брянский базовый медицинский колледж»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ДЛЯ ПРЕПОДАВАТЕЛЯ
Специальность: 33.02.01 Фармация
Учебная дисциплина: ОП. 09 Органическая химия
Тема: «Непредельные углеводороды»
Вид занятия: лекционное
Количество часов: 2 часа (90 минут)
Курс: 2
| Рассмотрена на заседании методической комиссии по специальности 33.02.01 Фармация «___» ___________ г. Протокол № ___ Председатель ___________ С.Н.Алексеева Рекомендована методическим советом «___» ___________г. Протокол №
| Утверждаю Зам. директора ГАПОУ «Брянский базовый медицинский колледж» ___________________М.А. Захарова « » _________________г
|
Методическая разработка лекционного занятия для преподавателя по теме: «Непредельные углеводороды» составлена в соответствии с федеральным государственным образовательным стандартом среднего профессионального образования по специальности 33.02.01 Фармация, утвержденного Приказом Минпросвещения России от 13 июля 2021 г. №449, а также примерной основной образовательной и рабочей образовательной программой по специальности среднего профессионального образования.
Автор: Петракова Е.А. преподаватель химии ГАПОУ «Брянский базовый медицинский колледж»
Рецензенты: Богданова Е.В., методисты ГАПОУ «Брянский базовый медицинский колледж»
Цели:
Образовательная: Дать полное представление о гомологическом ряде, химическом и электронном строении, изомерии и номенклатуре алкинов и алкенов. Рассмотреть особенности получения и отличительные свойства соединений данных классов.
В результате изучения темы «Введение» обучающийся должен:
знать/понимать:
- свойства алкинов и алкенов
- способы получения
- правила составления названий
На основе использования теоретических знаний уметь:
- прогнозировать направление протекания реакций,
- устанавливать природу и свойства веществ
В результате освоения темы формируется база для овладения следующими компетенциями и личностными качествами:
ОК 04 Работать в коллективе и команде, эффективно взаимодействовать с коллегами, руководством, клиентами
ОК 07 Содействовать сохранению окружающей среды, ресурсосбережению, эффективно действовать в чрезвычайных ситуациях
ОК 09 Использовать информационные технологии в профессиональной деятельности
ПК 2.5. Соблюдать правила санитарно-
гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности, порядок действий при чрезвычайных ситуациях
ЛР 1 Осознающий себя гражданином и защитником великой страны.
ЛР 10 Заботящийся о защите окружающей среды, собственной и чужой безопасности, в том числе цифровой.
ЛР 15 Проявляющий сознательное отношение к непрерывному образованию как условию успешной профессиональной и общественной деятельности
ЛР 16 Способный планировать и реализовывать собственное профессиональное и личностное развитие
Воспитательная: воспитание ответственного отношения к использованию химических веществ в лаборатории, быту, медицинских учреждениях с соблюдением техники безопасности.
Развивающая: использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- распознавания и идентификации важнейших дезинфицирующих и лекарственных веществ и материалов.
Внутридисциплинарные связи: тема является фундаментальной для изучения химических процессов и строения органических веществ.
Междисциплинарные связи: оптическая изомерия доказывается физическими методами, связь с Технологией изготовления лекарственных средств (алканы, алкены как основа для лекарственных форм).
Оснащение: методическая разработка для преподавателя, электронная презентация.
Использованная литература:
1.Зурабян, С.Э. Органическая химия / С.Э. Зурабян, А.П. Лузина, под ред. Т.А. Тюкавкиной. – Москва: ГЭОТАР–Медиа, 2019. – 384 с.
2. Тюкавкина, Н.А. Органическая химия / Н.А. Тюкавкина, В.Л. Белобородов, С.Э. Зурабян. – Москва: ГЭОТАР–Медиа, 2019. – 640 с.
Технологическая карта лекционного занятия
Лекция: Непредельные углеводороды
План:
Гомологический ряд, номенклатура алкенов и алкинов.
Структурная и пространственная изомерия непредельных углеводородов.
Химические свойства (реакции электрофильного присоединения, реакции окисления).
Способы получения.
| № этапа занятия | Содержание этапа занятия | Количество минут |
| Организационный момент | Тема, цель, актуальность, требования к изучению темы | 5 |
Гомологический ряд, номенклатура алкенов и алкинов.
| Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой. Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2— «аллил». Алкинами называют ненасыщенные углеводороды, содержащие тройную связь. Общая формула алкинов СпН2п-2. Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи. Простейший представитель алкинов — этин НС=СН — имеет тривиальное название «ацетилен», принятое номенклатурой ИЮПАК. Названия алкинов по заместительной номенклатуре строят аналогично названиям алкенов.
| 10 |
Структурная и пространственная изомерия непредельных углеводородов | Для алкенов и алкинов характерны изомерия углеродного скелета, положения двойной связи, межклассовая. Для алкенов также характерна пространственная изомерия. Алкены могут существовать в виде пространственных или геометрических изомеров. Различают: цис- изомеры: заместители расположены по одну сторону от двойной связи; транс- изомеры: заместители расположены по разные стороны от двойной связи.
| 15 |
Химические свойства (реакции электрофильного присоединения, реакции окисления).
| Реакции электрофильного присоединения(Ае)
В данных реакциях атакующей частицей является электрофил (например, НХ, где Х – галоген или ОН). Реагент присоединяется по месту разрыва пи-связи:  
Галогенирование Механизм Под влиянием π-электронов двойной связи молекула брома поляризуется и образует с π-электронами этилена неустойчивый π-комплекс: 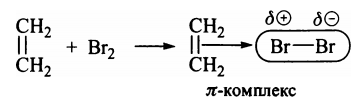 Дальнейшая поляризация связи Вr-Вr с образованием ионной пары и ее разделением за счет сольватации ионов растворителем дает более прочную ковалентную связь С-Вr. В результате π-комплекс трансформируется в карбокатион: 
3. На следующей более быстрой стадии механизма карбокатион притягивает нуклеофил брома и образуется 1,2 – дибромэтан. Более сложный пример механизма АЕ 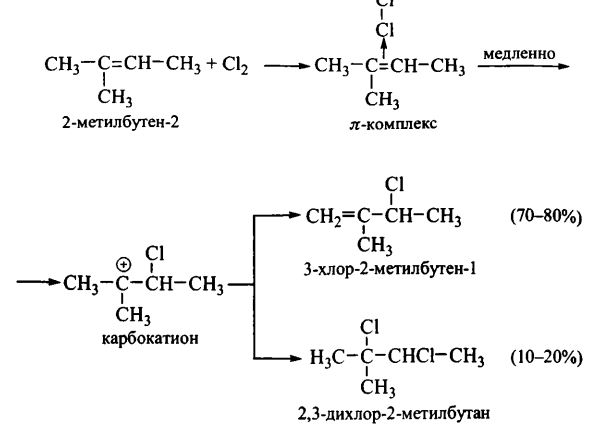
Гидрогалогенирование. Присоединение реагентов типа НХ к несимметричным алкенам идет по аналогичному бромированию механизму, но в данном случае возникает проблема направления присоединения. Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова: При взаимодействии молекул типа НХ с несимметричными алкенами, атом водорода присоединяется к атому углерода двойной связи, связанному с максимальным числом атомов водорода (к наиболее гидрогенизированному атому). 
Гидратация. Реакция присоединения воды к алкенам протекает в присутствии серной кислоты. Реакция протекает по правилу Марковникова. Вода является слабым электрофилом, и по этой причине ее прямое присоединение к алкенам осуществить не удается. Однако в присутствии сильных минеральных кислот в результате гидратации образуются спирты. 
Реакция окисления. 3СН2=СН2 +2КМnО4+4Н2О→3НОСН2-СН2ОН +2MnO2+2КОН – р-я Вагнера, также качественная на двойную связь. Это реакция гидроксилирования, в более жестких условиях: Пентен-2 окисляется до пропионовой и уксусной кислоты. Реакции полимеризации. Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионному механизму. По первому методу получают полиэтилен высокого давления: 
Катализатором реакции выступают пероксиды. Второй метод предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений (катализаторы Циглера-Натта, анионная полимеризация). Преимуществом метода является возможность получения стереоселективных полимеров. Кислотные свойства. Особенность алкинов, имеющих концевую тройную связь, состоит в их способности отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Это свойство обусловлено значительной поляризацией сигма связи С-Н вследствие высокой электроотрицательности атома углерода в состоянии sр-гибридизации (2,8 по шкале Полинга,). Поэтому алкины с концевой тройной связью способны, в отличие от алкенов, образовывай соли, называемые ацетиленидами. 
Ацетилениды серебра и меди(1) легко образуются и выпадают в осадок при пропускании ацетилена или монозамещенного ацетилена через аммиачный раствор оксида серебра Ag20 или хлорида меди(1) Ацетиленид серебра — белый, постепенно темнеющий осадок, ацетиленид меди — осадок красновато-коричневого цвета. Обе реакции являются качественными на алкины с концевой тройной связью. 
Гидратация. Присоединение воды к алкинам протекает в присутствии катализаторов — солей ртути(ll) и сильных кислот. Реакция была откры М.Г. Кучеровым (1881) и носит его имя. Ацетилен этим путем превращается в уксусный альдегид. 
Присоединение воды приводит поначалу к образованию ненасыщенного спирта, в котором группа ОН находится у двоесвязанного атома углерода. Такие спирты называют виниловыми или енолами. Они неустойчивы и мгновенно изомеризуются в более стабильные карбонильные соединения — альдегиды или кетоны. Гидратация несимметричных алкинов протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. 
| 35 |
Способы получения | Получение. Реакции элиминирования (Е) Е – отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними пи-связи. 1. Дегидрирование алканов.  , а также возможен выход бутадиен -1,3 , а также возможен выход бутадиен -1,3 Это один из промышленных способов получения алкенов. Температура: 350—450 °C, катализатор — Cr2O3. Также используются алюмомолибденовые и алюмоплатиновые катализаторы. 2. Дегидрогалогенирование и дегалогенирование алканов. Отщепление галогенов у дигалогеналканов происходит в присутствии цинка:  3. Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей: R –CHBr-CH3 +C2H5ONa→R-CH=CH2 +NaBr + C2Н5ОН Правило Зайцева —при дегидратации вторичных и третичных спиртов и при дегидрогалогенировании вторичных и третичных галогенидов водород отщепляется преимущественно от наименее гидрогенизированного атома углерода. (Отщепление протона происходит от менее гидрированного атома углерода.) Дегидратация спиртов 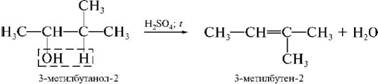 Дегидратацию спиртов ведут при повышенной температуре в присутствии сильных минеральных кислот. Способы получения алкинов 1) Общий способ получения алкинов состоит в отщеплении двух молекул галогенводорода от дигалогеноалканов (реакция дегидрогалогенирования. При этом галогениды должны содержать атомы галогена либо у соседних атомов углерода, либо у одного и того же атома. Реакция идет ступенчато.

2) Особую практическую значимость имеет ацетилен, для которого разработан ряд промышленных методов получения. Один из них — пиролиз природного газа. 2СН4→НС≡СН + 3Н2 (при Т=1500С0). 3) Другой метод, разработанный Ф. Вёлером еще в 1862 г. и не утративший значения до настоящего времени, называется карбидным методом. Суть его заключается в гидролизе карбида кальция СаС2, получаемого при прокаливании оксида кальция с углеродом. 
Гидролиз карбида кальция используют и как лабораторный способ получения ацетилена.
| 10 |
| Домашнее задание | Глава 5, зад 5.3-5.5, 5.24, 5.25. | 5 |
| Закрепление
| 1. Какое свойство появляется у алкинов в сравнении с другими классами УВ? 2. Какова качественная реакция на наличие концевой тройной связи? 3.Назовите отличительные свойства алкенов и алканов. 4. Какова качественная реакция на наличие двойной связи? 5. Что доказывает реакция Вагнера?
| 5 |
| Рефлексия | Подведение итогов. Ответы на вопросы студентов | 5 |















 , а также возможен выход бутадиен -1,3
, а также возможен выход бутадиен -1,3