ГБУ ОО ЗО «Константиновская СОШ № 2 им. Героя Советского Союза П.Т. Одинца.»
г. о. Мелитополь
План -конспект открытого урока в соответствии с требованием ФГОС
Тема. Железо.
Разработала: Левченко С.П.,
учитель химии 1 категории
Класс: 9
Тема урока. Железо.
Эпиграф урока:
Среди металлов самый главный
Важнейший древний элемент.
В тяжелой индустрии -главный,
Знаком с ним школьник и студент.
Родился в огненной стихии,
А сплав его течет рекой.
Важнее нет в металлургии,
Он нужен всей стране родной
Цель урока: систематизировать ранее полученные и изучить новые знания о физических и химических свойствах железа, познакомиться с распространенностью железа, его соединениями в природе, значением железа для человека.
Задачи:
Образовательные:
- сформировать у учащихся понятия про особенности строения атомов железа; характеризовать положение железа в периодической системе химических элементов Д. И. Менделеева;
-составить полное представление об элементе и простом веществе- железе; его физических и химических свойствах, опираясь на знания зависимости свойств металлов от строения их атомов.
Развивающие:
- развитие умений устанавливать взаимосвязь между составом, строением и свойствами веществ;
-способствовать развитию познавательной активности и самостоятельности учащихся в приобретении новых знаний, умений, навыков работы с текстами и справочными материалами;
-способствовать развитию исследовательских навыков и логического мышления;
-развитие у учащихся представления о единстве окружающего мира на основе информации о разных формах существования железа и его нахождение в природе. Воспитывающие:
- содействовать в ходе урока формированию аккуратности, внимания во время проведения эксперимента, совершенствованию техники безопасности;
-создать условия для воспитания активности и самостоятельности при изучении данной темы, умения работать в группе, у доски, умения слушать своих одноклассников.
Планируемые результаты обучения:
Предметные: уметь характеризовать элемент железо на основании его положения в ПСХЭ Д.И.Менделеева, в электрохимическом ряду напряжений и электронного строения атома, описывать физические и химические свойства железа, уметь определять возможные степени окисления железа в соединениях, составлять уравнения химических реакций , протекающих с участием железа в ионном и окислительно-восстановительном виде .
Метапредметные: способствовать развитию умений использовать научные методы познания-наблюдение, гипотеза, эксперимент, развивать умения работать с информацией, способности к анализу и самоанализу, вниманию, речевым навыкам,
умения описывать демонстрационные эксперименты.
Личностные: формировать умения управлять своей учебной деятельностью, самостоятельно принимать решения на определенных этапах деятельности, помочь в подготовке к осознанию выбора дальнейшей образовательной траектории.
Тип урока: урок изучения нового материала.
Оборудование и реактивы: штативы для пробирок, пробирки, пробиркодержатели, химические стаканчики, минералы (магнитный железняк, бурый железняк, пирит), железо металлическое, железо (порошок), сера (порошок), растворы сульфата меди, сульфата железа, соляной кислоты, железный гвоздь.
Материалы: Периодическая таблица химических элементов Д. И. Менделеева, интерактивная доска, таблица «Ряд активности металлов», таблица растворимости веществ, инструктивные карточки, план характеристики элемента.
Формы работы учащихся: фронтальная, групповая и индивидуальная.
Методы:
- игровые;
-словесные (беседа, диалог);
-проблемно-поисковый (решение проблемной задачи);
-наглядные (работа с рисунками и схемами, презентация, видеоопыты)
-дедуктивные (анализ, обобщение, применение знаний).
Учебник. Габриелян О.С., И.Г. Остроумов, С.А. Сладков. Химия: 9 класс. – 4-е изд. – М.: Просвещение, ,2022.
На доске: тема, карта путешествия.
Ход урока.
1.Организационный момент (приветствие, проверяется готовность класса к уроку)
II. Сообщение темы и цели урока. (слайд 1)
Ребята! В этой шкатулке находится хорошо известное вам вещество.
Это металл войны и мирной техники.
В давние времена из него изготавливали украшения, которые были в четыре раза дороже золотых, в семь раз - серебряных.
Гимном этого металла есть Эйфелева башня в Париже.
Алхимический знак этого металла -  ,это символ планеты Марс.
,это символ планеты Марс.
Это «небесный металл»
Этот металл был основным материалом для изготовления боеприпасов и оружия в годы ВОВ (Ученица у доски решает задачу)
Задача.
В результате растворения в серной кислоте двухвалентного металла (из которого изготавливали оружие и боеприпасы) массой 5,6 г выделился водород объемом 2,24 л ( н.у.).назовите этот металл.(Ответ: Fe)
7.Что это за металл? (Fe, железо)
Дети, на сегодняшнем уроке мы познакомимся с элементом побочной подгруппы – железом, строением его атома, а также физическими и химическими свойствами простого вещества железа, распространением его в природе , значением.
Запишем тему нашего урока: «Железо.»
Чрезвычайно важное место занимает этот металл в жизни человека. Поэтому цель сегодняшнего урока – составить полное представление об элементе и о простом веществе – железе.
III. Мотивация учебной деятельности. (слайд 2)
А задумывался ли кто-нибудь из вас, что было бы, если все железо исчезло на земле и не осталось бы ни одного грамма этого элемента?
“...На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, ни паровозов, ни автомобилей... не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без живительного металла.
Разрушение ураганом прошло бы по всей земле, и гибель человечества сделалась бы неминуемой. Впрочем, человек не дожил бы до этого момента, ибо, лишившись трех граммов железа в своем теле и в крови, он бы прекратил свое существование раньше, чем развернулись бы нарисованные события. Потерять все железо — пять тысячных процента своего веса — было бы для него смертью!”
Эту картину нарисовал академик А. Е. Ферсман.
IV. Актуализация опорных знаний.
Как вы уже поняли, сегодня у нас необычный урок мы совершим путешествие по станциям. Для организации работы на уроке, нам необходима сплочённость коллектива, чтобы достичь желаемого результата. Возьмите за руку своего соседа и пожелайте успеха в работе.
Но прежде, чем отправится в путь. необходимо проверить все ли готовы к путешествию и проверить ваш багаж знаний.
Разминка. (слайд 3)
Задание 1.
У какого металла сильнее выражены восстановительные способности:
а) алюминий;
б) натрий;
в) магний?
Задание 2.
Заберите лишнее вещество из списка FeO, FeCl2, FeS, FeSO4.
Задание 3.
Какое количество электронов на внешнем энергетическом уровне у металлов?
Задание 4.
Определите соответствие: металл - планета.
Золото -(Солнце)
Серебро- (Луна)
Медь -(Венера)
Олово – (Юпитер)
Свинец –(Сатурн)
Железо –(Марс)
Ртуть –(Меркурий)
V. Открытие новых знаний.
У вас получилось, все готовы к путешествию. Я даю Вам зелёный свет! Вперед!
Звук поезда.
Мы сели в поезд,
Вы пассажиры- я проводник,
А ваши тетради -путевой дневник!
Путешествие предлагаю начать с путевого дневника, то есть с вашей рабочей тетради.
По пути следования мы сделаем несколько остановок на различных станциях.
1.Станция «Историческая» (слайд 4)
История открытия железа (рассказ учащегося)
Железо в переводе с шумерского языка – это металл, “капнувший с неба, небесный”.
Оно тысячелетиями было знакомо людям лишь в небесном обличии. Темные куски камней, похожие на металл, падали прямо с неба и плавились земным огнем За 3а 3 миллиарда лет на Землю выпало около 150 млрд тонн метеоритного железа.
Впервые доказал, что “железные камни падают с неба”, в 1775 г. русский ученый П.С. Палас, который привез в Петербург глыбу самородного железного метеорита весом 600 кг.
Самым крупным железным метеоритом является найденный в 1920 г. в Юго-Западной Африке метеорит “Гоба” весом около 60 т.
Работа с карточками.
Разместите таблички Медный век, Бронзовый век, Железный век в хронологическом порядке.
Учитель. На смену бронзовому веку пришел век железный. Правда, небесный металл, который содержит никель, не поддается изучению в обычных условиях, его необходимо обрабатывать, как ни странно в холодном виде, а не в разогретом.
Век девятнадцатый, железный
Воистину жестокий век!
Тобою в мрак ночной, беззвездный
Беспечный брошен человек!
Восточная легенда повествует о том, как египетский султан и полководец XII века Сала дин (Салах-ад-дин) состязался в ловкости и воинском искусстве с английским королем Ричардом I по прозвищу Львиное Сердце. Могучим ударом меча Ричард разрубил пополам копье одного из рыцарей, продемонстрировав тем самым высокую прочность клинка и собственную силу. В ответ Саладин подбросил в воздух тонкий шелковый платок и рассек его своей саблей, что говорило не только о ловкости султана, но и об удивительной остроте его оружия. (слайд 5)
По преданию, одни из лучших на Востоке клинков изготовляли мастера из Аджлуна (на севере Иордании). В средние века здесь было широко развито оружейное дело и на протяжении нескольких столетий Аджлун снабжал саблями, мечами, кинжалами армии арабских халифатов, воевавших с крестоносцами и другими завоевателями.
Недавно археологи обнаружили в окрестностях Аджлуна остатки кузнечных мастерских и заброшенные копи, где горняки средневековья добывали железную руду. Находка археологов еще раз подтвердила высокий уровень развития металлургии и оружейного дела, достигнутый древними аджлунскими мастерами.
2. Станция «Литературная» (слайд 6)
Учитель. Герою знаменитого романа Даниэля Дефо повезло. Корабль, из которого он спасся, сидел на мели, совсем недалеко от острова. Робинзон сумел нагрузить на плот все необходимою и благополучно переправиться на остров. Ему повезло еще раз-цитируем роман «После долгих поисков я нашел ящик нашего плотника, и это для меня была поистине драгоценная находка, которую я не отдал бы тогда за целый корабль с золотом …»
Что же было в этом ящике? Да, обычные железные инструменты: пила, молоток, гвозди.
Через два столетия на другой необитаемый остров попали герои другого известного романа («капитан Немо») - пятеро американцев. Они сумели не только выжить на острове, но и создать более, менее нормальные условия жизни, что никогда не удалось бы, если бы инженер Сайрес Смит не смог бы найти на таинственном острове железную руду и изготовить железные инструменты.
В «Одиссее» Гомера говорится о том, что победителю игр, устроенных Ахиллесом, была назначена награда: кусок золота и кусок железа.
3.Станция «Геологическая» (слайд 7-8) (работа с презентацией)
Учитель. По современным представлениям в 16-километровой толще земной коры содержится 4,5 % железа. В следующем слое железа втрое больше. Центр земного шара состоит в основном из железа с примесями никеля и кобальта. В среднем земной шар состоит на 34,6% из железа. Он является самой важной составной частью нашей планеты.
Самые важные природные соединения железа:
Демонстрация минералов.
Заполнение таблицы (таблица выдается учителем каждому на отдельных листах и затем ученики вклеивают ее в тетрадь) (Приложение1)
|
|
|
|
|
|
| Название минерала | Химическая формула | Содержание железа
(в %) | Важнейшие месторождения | Применение |
| Магнитный железняк
(магнетит) |
|
|
|
|
| Красный железняк
(гематит) |
|
|
|
|
| Бурый железняк
(лимонит) |
|
|
|
|
| Шпатовый железняк
(сидерит) |
|
|
|
|
| Серный колчедан
(пирит) |
|
|
|
|
4. Станция «Периодическая система»
Игра химический хоккей (слайд 9)
Два ученика по очереди характеризуют положение железа в Периодической системе.
(Элемент 8 группы побочной подгруппы; валентные электроны находятся на внешнем и предвнешнем слое: это d-элемент, порядковый номер 26, относительная атомная масса-56, заряд ядра -26, протонов -26, 26 -электронов ,30- нейтронов,)
Запись в тетради (слайд 10)
Электронная формула1S22S22P63S2 3Р6 3Д6 4S2
Порядковый номер--------, период -------, группа------, п/группа ------------относительная атомная масса----------.
Заряд ядра------, число электронов-------, число протонов------------, число нейтронов------.
Распределение электронов по энергетическим уровням
Учитель обращает внимание учащихся, что данный элемент имеет незавершенный энергетический уровень, т.е. застраивается до 18 – третий энергетический уровень Железо – d -элемент.
5. Станция «Физическая»
Работа с учебником. (Приложение 2)
Заполните таблицу пользуясь материалом учебника (слайд 11)
| Физические свойства | Характеристика |
| Агрегатное состояние |
|
| Цвет |
|
| Пластичность |
|
| Магнитные |
|
| Ковкость |
|
| Теплопроводность |
|
| T плавления |
|
Учитель. Способность притягиваться магнитом и быть самому магнитом-одна из удивительных способностей железа. Явление магнетизма было известно еще в глубокой древности. Слово магнетизм происходит от названия горы Магнезии в Малой Азии. Там существовало большое месторождение магнитного железняка. Практическое применение магнетизм получил гораздо раньше, чем началось его научное исследование. Мореплаватели издавна пользовались компасом с магнитной стрелкой.
В 1775 году швейцарский ювелир И. Дитрих впервые изготовил подковообразный магнит. (слайд 12)
6. Станция «Химическая» (слайд13-19)
Акцентируется внимание учащихся на том, что элемент находится в побочной подгруппе. Какая степень окисления может быть у железа?
У железа может быть ещё степень окисления +3. Учитель говорит о том, что элементы побочных подгрупп имеют, как правило, несколько степеней окисления. Пример тому- железо.
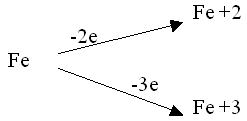
Чем сильнее взаимодействующий с железом окислитель или выше его концентрация, тем глубже идет окисление, выше показатель степени окисления.
Сильные окислители: О2, Сl2, концентрированные кислоты HNО3 и H2SО4 - при нагревании образуют соединения Fe+3.
Слабые окислители: S, Н2О, разбавленные кислоты, растворы солей - образуют соединения Fe +2
Железо- металл средней активности, восстановитель. При обычной температуре не реагирует даже с сильными окислителями. При нагревании его активность повышается.
Ученики с помощью учителя записывают на доске уравнения реакций.
1.Взаимодействие с простыми веществами при нагревании
а) с кислородом (видеоопыт)
3Fe+2О2→Fe3О4
железная окалина
б) с галогенами (видеоопыт)
Под действием фтора, хлора и брома при нагревании железо образует соответствующие галогениды железа:
2Fe+3Cl2→2Fe+3Cl3
в) с серой.
Fe+S→Fe+2S (видеоопыт)
2.Взаимодействие со сложными веществами
а) с растворами кислот
Fe+2HCl→Fe+2Cl2+H2 ↑ (демонстрация опыта)
При комнатной температуре концентрированные серная и азотная кислоты пассивируют железо, и оно в них не растворяется, так как на поверхности металла возникает пленка, препятствующая реакции металла с кислотой. Поэтому концентрированные серную и азотную кислоты можно перевозить в железной таре
При нагревании железо реагирует с концентрированными кислотами.
б) с солями
Задание для класса.
Для борьбы с садовыми вредителями применяют раствор медного купороса. Можно ли готовить и хранить раствор медного купороса в железном ведре?
Для этого проведем небольшой опыт (демонстрация опыта).
Спорим в моих руках железо может тоже, как человек «стыдиться» и оно покраснеет!?
Fe + CuSO4 = Fe SO4 + Cu
Железо вытесняет (восстанавливает) металлы, которые в ряду активности стоят правее от него, с из растворимых солей.
А может ли медь вытеснять железо из раствора ее соли? Почему?
в) при высокой температуре железо реагирует с парами воды:
3Fe+4H2О →Fe3О4+4H2 ↑
7. Станция «Биологическая» (слайд 20)
Учитель. В организме взрослого человека содержит приблизительно 4-5 г железа, из которых около 70 % входит в состав гемоглобина. Суточная норма для взрослого человека составляет около 15 мг, для ребенка -7 мг. Основная роль гемоглобина -перенос кислорода из легких в ткани и в обратном порядке-СО2. Большая часть железа содержится в клетках печенки, селезенки и костного мозга.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, принимает участие в процессе фотосинтеза. В результате нехватки железа растения не образуют хлорофилл (участвует в процессе фотосинтеза), теряют возможность ассимилировать углекислый газ и выделять кислород. Без железа листья у растений белеют. У животных и человека в результате нехватки железа развивается анемия (малокровие).
Так от одной и той же причины-наличия железа в соках растений и в крови человека-весело зеленеют листья и ярко румянятся щеки человека.
Сообщения ученика .Роль железа в организме человека.
Поддерживает иммунную систему
Переносит кислород
Отвечает за процесс кроветворения
Берет участие в обмене веществ
Обеспечивает рост тела
Отвечает за воспроизводство ДНК
Много ионов железа содержится в козьем и коровьем молоке, яичном желтке
Основные источники железа:
Зеленые овощи
Яичный желток
Печенка
Горошек зеленый
Томаты сырые
Капуста
Чеснок
Яблоки, груши
Земляника
8. Станция «Медицинская» (слайд21)
Учитель. Тест «Все ли в порядке у вас с железом?»
На вопросы отвечайте «да» или «нет».
1.Часто ли вы испытываете утомляемость и подавленность?
2.Происходили ли у вас в последнее время изменения кожи, волос, ногтей?
3.Теряли ли вы в последнее время много крови?
4.Занимаетесь ли вы профессиональным спортом?
5.Вы редко или совсем не едите мясо?
6. Выпиваете ли вы в день больше трех чашек чая или кофе в день?
7.Вы мало едите овощей?
Если на большинство вопросов вы ответили «нет», то ваш организм в достаточной степени обеспечен железом. (слайд 22)
Сообщение ученика «Магнетит» (применение магнетита в медицине).
VI. Первичное закрепление материала. (слайд 23)
Блиц-турнир (экспресс -опрос)
1.Какую максимальную степень окисления имеет Феррум в соединениях? (+3)
2.Назовите формулу красного железняка& (Fe2O3)
3.Какую степень окисление проявляет Fe при взаимодействии с разбавленными кислотами? (+2)
4. В каких случаях Fe проявляет степень окисления +3 (с галогенами)
5.Сколько электронов содержится на внешнем энергетическом уровне у атома железа? (2)
6. Какую болезнь вызывает нехватка железа в организме человека? (анемию)
7. Fe — это s-, p- или d -элемент? (d -элемент)
8. Назовите формулу магнитного железняка (Fe3O4).
9.Как можно отделить железную стружку от деревянных опилок? (действием магнита)
10.Какие свойства проявляют атомы железа -окислительные или восстановительные?
11.При взаимодействии с растворами солей Fe проявляет степень окисления… (+2).
12.Можно ли перевозить в железных цистернах концентрированную серную кислоту?
VII. Итоги урока. Рефлексия.
Учитель. Я считаю, что теперь вы уверены, что железо — это металл, который заслуживает того, чтобы ему пели гимн (кстати слово гимн в Древней Греции означало «хвалебная песня»).
(Ученица читает стихотворение «Ода железу»)
Не золото и серебро
Мы славить будем,
Драгоценный их блеск
Без жалости забудем.
Железу поем
Слова величавые.
Металл этот считаем
Достойным славы.
Славься, Железо,
Металл всесильный.
Без тебя, Железо,
Прогресс бессилен.
Мечи и орала,
победы в боях,
В полях и на нивах,
в морях, на путях,
Железо могучее,
Сильное, прочное,
Мы славим и благодарим тебя воочию.
Учитель. Ребята, наш урок подошел к концу, и мы незаметно оказались дома. Оцените, пожалуйста, свою работу на уроке. Поставьте галочку в таблице по рефлексии, а на цветочке нарисуйте смайлик своего настроения.
VIII. Домашнее задание (слайд 24)
Работа с учебником § 34 (стр.172-174), ответы на вопросы после параграфа 1-3, задан.5(б) стр.177, напишите синквейн о железе.
Приложение 1
| Название минерала | Химическая формула | Содержание железа
(в %) | Важнейшие месторождения | Применение |
| Магнитный железняк
(магнетит) |
|
|
|
|
| Красный железняк
(гематит) |
|
|
|
|
| Бурый железняк
(лимонит) |
|
|
|
|
| Шпатовый железняк
(сидерит) |
|
|
|
|
| Серный колчедан
(пирит) |
|
|
|
|
Приложение 2
Заполните таблицу пользуясь материалом учебника (слайд 11)
| Физические свойства | Характеристика |
| Агрегатное состояние |
|
| Цвет |
|
| Пластичность |
|
| Магнитные |
|
| Ковкость |
|
| Теплопроводность |
|
| T плавления |
|
Список использованных источников.
1. Н.А. Гара. Уроки химии 9 класс.
2. Курганская С.М. Внеклассная работа по химии: Викторины и химические вечера. – М.: 5 за знания, 2006. – 192 с.
3.Беккерт М. Железо. Факты и легенды. - М.: Металлургия, 1998.
4.Ферсман А.Е. Занимательная геохимия. – Л.: Детгиз,1954
3.www.catalogmineralov.ru – сайт содержит каталог минералов, большую коллекцию фотографий и описание минералов.
5. Энциклопедия химических элементов / Под. Ред. А.М. Смолеговского. М.: Дрофа, 2000.
6.http://.elementy.ru – сайт « Элементы большой науки», содержит каталоги и статьи научно-популярных журналов «Химия и жизнь», « Наука и жизнь», «Природа» и др.
7.http://www.ovitanah.com - сайт посвящен витаминам и микроэлементам, содержит интересную информацию.
8.http://alhimik.ru – сайт «Алхимик
9.https://multiurok.ru/
















