Отдел по вопросам образования администрации
Ардатовского муниципального района
Методическая разработка раздела образовательной программы
«Изменения, происходящие с веществами»
образовательной программы "Химия"
Выполнил:
Вагина Валентина Ивановна
учитель химии
МБОУ «Саконская СОШ»
2011 – 2012 учебный год
Содержание
1.Пояснительная записка 3
2.Цели и задачи обучения 4
3.Учебно–методический комплект 5
4.Психолого-педагогические особенности подросткового возраста 6
5.Тематическое планирование раздела 7
6.Технологии и формы организации деятельности, методы и приёмы изучения раздела 8
7.Результаты апробации содержания данного раздела программы 9
8.Педагогическое мастерство учителя 10
9.Конспект урока «Обобщение по теме «Типы химических реакций»» 11
10.Психолого-педагогическая характеристика класса 12
11.Приложения к конспекту урока 24
12.Список литературы для учителя 28
Пояснительная записка.
В наступившем 21 веке общество предъявляет все более высокие требования к образованию в школе: к его содержанию, структуре, к компетентности учителя.
Учебно - методический комплект и авторская программа О.С. Габриеляна соответствуют федеральному компоненту государственного стандарта общего образования и позволяют осуществить совокупность задач основного и среднего образования.
При распределении программного материала по классам учитывается прежде всего внутренняя логика самого учебного предмета, те связи и зависимости, которые существуют между отдельными сторонами предмета, его категориями. Принимаются во внимание также и возрастные возможности детей, особенности их познавательной деятельности.
Весь теоретический материал курса химии для основной школы рассматривается на первом году обучения, что позволяет учащимся более осознанно и глубоко изучить фактический материал – химию элементов и их соединений. Наряду с этим такое построение программы даёт возможность развивать полученные первоначально теоретические сведения на богатом фактическом материале химии элементов. В результате выигрывают обе составляющие курса: и теория и факты.
Методическая разработка темы «Изменение, происходящие с веществами» предназначена для учащихся 8 классов. Она составлена на основе программы курса химии для 8-11 классов общеобразовательных учреждений автора О.С. Габриелян.
Тема является одной из важных курса химии, так как знание типов химических реакций и закона сохранения массы веществ дает возможность управлять превращениями веществ, находить экономически безопасные способы производства веществ и материалов и охраны окружающей среды от химических загрязнений.
Освоение важных знаний и овладение умениями и навыками по теме служит фундаментом для изучения дальнейшего курса химии.
Целью обучения
в разделе "Изменения, происходящие с веществами", является формирование личности:
обладающей знаниями основ химической науки как фундамента современного естествознания;
убеждённой в материальном единстве мира веществ и объективности химических явлений;
понимающей необходимость сбережения природы - основу жизни на Земле.
При разработке раздела "Изменения, происходящие с веществами" были поставлены задачи:
Образовательные
Формирование целостной картины мира.
Формирование практических умений и навыков.
Систематизация знаний о химических реакциях.
Развивающие
Развитие и совершенствование умений и навыков учебной деятельности.
Развитие способностей формулировать свои мировоззренческие позиции в процессе изучения темы.
Развитие познавательного интереса.
Развитие умения сравнивать, анализировать, делать выводы
Воспитательные
Становление и развитие нравственных и мировоззренческих устоев личности.
Воспитание трудолюбия, целеустремлённости и аккуратности
Результатом обучения будет:
Будут знать
сущность химических реакций
классификацию химических реакций по различным признакам
взаимосвязь химических превращений между неорганическими и органическими веществами
Будут уметь
распознавать химические реакции по типам, объяснять механизмы протекания химических реакций
решать задачи различных типов
Образовательная программа "Химия" О.С. Габриеляна представлена учебно-методическим комплектом.
В него входят:
Программа курса "Химия" 8-11 класс для общеобразовательных школ
Учебники 8-11 класс
Рабочие тетради к учебникам
Контрольные и проверочные работы
Методические рекомендации для учителя
Одним из основных и важнейших понятий в химии, является "Химическая реакция".
Знания о химической реакции представляет собой систему, которая постепенно формируется у учащихся в процессе обучении химии. На основе атомно-молекулярной теории её стали рассматривать как процесс превращения молекул одних веществ в молекулы других за счёт перегруппировки атомов. Развитие знаний о строении вещества позволило создать электронную теорию строения атома. С появлением этой теории сущность химической реакции стала рассматриваться в зависимости от изменения характера химических связей между атомами в веществе. Глубокое изучение химических реакций предполагает формирование у учащихся представления о том, что внешние явления при химическом превращении закономерно связаны с внутренней его сущностью. При реакции разрывается одни химические связи и возникают новые, и как следствие этого - одни вещества превращаются в другие.
Этапы изучения темы "Химические реакции"


 9 класс 10 класс
9 класс 10 класс
Расширение знаний Особенности химических реакций

 о химических реакциях в органической химии
о химических реакциях в органической химии

Химические реакции




8 класс 11 класс
Первоначальные понятия Повторение, систематизация
знаний
Психолого – педагогические особенности подросткового возраста
Введение предмета химии в обучение происходит сравнительно поздно (в 8 классе) по сравнению с другими предметами (биологией, физикой, географией и т. д). Это объясняется тем, что для начала изучения химии необходимы определённые знания из других предметов, прежде всего физики, и что данный предмет требует серьёзного отношения к себе.
Учащихся подросткового возраста отличает:
Быстрый рост, развитие и перестройка организма ребенка.
Стремление к познанию, активность, инициативность, упорство в достижении цели.
Увеличение объема памяти, избирательность внимания.
Формирование активного самостоятельного, творческого мышления.
Нарастание способностей к абстрактному мышлению
Диаграммы усвоения знаний, умений и навыков учащимися 8 класса

![]()
![]()
8 класс
| Тема | Содержание темы | Деятельность учащихся |
| 1.Физические и химические явления. Химические реакции.
| Формирование понятий о физических и химических явлениях.
| Учатся распознавать, разделять и анализировать природные явления. Работают с раздаточным материалом. Выполняют лабораторную работу |
| 2. Химические уравнения. Закон сохранения массы веществ | Закрепление знаний о признаках химических реакций. Формирование закона сохранения массы веществ при химических реакциях.
| Учатся записывать уравнения химических реакций. Знакомятся с работами М.В. Ломоносова.
|
| 3.Расчёты по химическим уравнениям.
| Получение информации о реакции из её уравнения. Формирование умения вычислять по уравнениям реакций.
| Решают задачи по уравнениям химических реакций.
|
| 4. Реакции разложения.
| Формирование знаний о реакциях разложения.
| Знакомство с термохимическими уравнениями и особенностями их записи.
|
| 5.Реакции соединения. | Формирование знаний о реакциях соединения.
| Учатся составлять уравнения реакций соединения.
|
| 6.Реакции замещения. | Формирование знаний о реакциях замещения.
| Закрепляют умение составлять уравнения, знакомятся с рядом напряжения металлов.
|
| 7.Реакции обмена. | Формирование знаний о реакциях обмена. | Знакомство с правилом Бертолле, закрепляют умение составлять уравнения реакций |
| 8.Типы реакций на примере воды.
| Закрепление знаний о типах химических реакций, химические свойства воды.
| Закрепление знаний и умений о типах химических реакций.
|
| 9. Обобщение и систематизация знаний по теме.
| Отработка умения составлять уравнения химических реакций и решать расчётные задачи, подготовка к контрольной работе.
| Отрабатывают и закрепляют умения различать физические и химические процессы. Подготавливаются к контрольной работе. Выполняют задания различного вида |
| 10.Контрольная работа | Проверка усвоения знаний и умений учащимися | Выполняют задания контрольной работы по карточкам.
|
При проведении уроков использую следующие технологии и формы организации деятельности:
ИКТ (информационно коммуникативные технологии)
Здоровьесберегающие технологии
Коммуникативные технология
Классно-урочная система
Урок (комбинированный, сообщения новых знаний, формирования и закрепления умений и навыков, обобщающий, контрольный)
домашняя работа
внеклассная работа
внеурочная работа
экскурсии
факультативы
Лекционно-семинарская система
лекция - практикумы
семинар - экзамены
зачёт - собеседование
консультация
Методы и приёмы изучения
Соблюдение правил техники безопасности
Учёт закона сохранения масс веществ при расчётах
Анализ и распределение природных явлений
Проведение тематических диктантов
Использование наглядных таблиц
Составление схем химических реакций
Работа со схемами реакций
Проведение тематических викторин
Систематизация знаний
Проведение лабораторных опытов
Закрепление знаний химических свойств
Выполнение практических заданий
Проведение самостоятельных работ
Возможность применения теоретических знаний на практике
Использование видеофильмов и презентаций
Демонстрация опытов
Использование знаний при решении экологических проблем
Результаты апробации содержания данного раздела программы представлены по каждому классу в форме аналитического отчёта по годам:
2008 – 2009 учебный год.
| Класс | «5» | «4» | «3» | «2» | Успеваемость | Качество знаний |
| 8 | 3 | 5 | 6 | 0 | 100% | 57% |
2009 – 2010 уч. год.
| Класс | «5» | «4» | «3» | «2» | Успеваемость | Качество знаний |
| 8 | 3 | 4 | 5 | 0 | 100% | 58% |
2010 – 2011 уч. год.
| Класс | «5» | «4» | «3» | «2» | Успеваемость | Качество знаний |
| 8 | 4 | 4 | 5 | 0 | 100% | 64% |
Вывод:
Система работы по данному разделу - целенаправленный процесс, в результате которого учащиеся убеждаются в том, что "химическая реакция" является одной из важных форм движения материи, через которую происходят познания целостности картины мира.
Педагогическое мастерство учителя
Всё начинается с любви…
Твердят:
«Вначале было слово…»
А я провозглашаю снова:
Всё начинается с любви!
Всё начинается с любви:
И озаренье, и работа,
Глаза цветов, глаза ребёнка-
Всё начинается с любви-
С любви!
Я это точно знаю.
/Р. Рождественский/
Это стихотворение стало эпиграфом моей работы. Я согласна с мыслями поэта, с каждым его словом. Надо любить своих учеников всех вместе и каждого по отдельности – со всеми их недостатками и достоинствами. Каждому ученику хочется услышать ласковое слово, адресованное именно ему, каждому хочется, чтобы учитель видел в нём доброе начало.
Школа стала для меня моим вторым домом, куда я спешу каждый день. И хочется, чтобы в этом доме тебя встречали добрые приветливые улыбки твоих учеников, которые не боятся быть смешными и непонятными.
Каждый жест учителя, каждое его слово должно быть таким, чтобы ребёнок хотел идти за ним, идти вместе с ним.
Твёрдо убеждена, что в основе учительской работы должна быть любовь к детям, предполагающая взаимопонимание, сотрудничество. Нужно не перевоспитывать, а принимать
его личность такой, какая она есть.
На своих учениках стараюсь обогатить эту личность знаниями, умениями, эмоциями. В современных условиях, чтобы соответствовать требованиям сегодняшнего дня, необходимо искать новую информацию, умело управлять ею и использовать в своей работе. В целях развития творческих способностей учащихся особое внимание уделяю индивидуальной работе, что позволяет им быть успешными в смотрах различных направлений: в олимпиадах, в международных играх по предметам, например «Русский медвежонок», где дети получают дипломы и благодарственные письма. Стремлюсь к тому, чтобы, обучая, воспитывать и развивать ученика. Стараюсь воспитывать на уроках всё: личность самого ученика, строго отбираю материал, использую на уроках современные методы обучения. Использование информационных технологий становится в образовании актуальной задачей. Поэтому в своей работе стараюсь использовать ИКТ.
Проведение уроков с наглядной компьютерной демонстрацией помогает учащимся лучше запомнить материал и более глубоко проникнуть в суть изучаемого вопроса. Приучаю детей уважать друг друга и других людей, их мнения, ценности, тем самым пытаюсь развивать у будущих граждан гибкое масштабное толерантное мышление.
Конспект урока.
Предмет, класс: Химия,8 класс
Тема: Обобщение по теме «Типы химических реакций»
Программа курса химии для 8-11 классов общеобразовательных учреждений
автор О. С. Габриелян-М., Дрофа,2008г.
Тип урока: Урок обобщения и систематизации знаний.
(комбинированный урок)
Вид урока: урок игра – путешествие

Психолого – педагогическая
характеристика класса.
В классе обучается 12 человек. Из них 9 мальчиков и 3 девочки. По итогам успеваемости за 2010-2011 учебный год в классе 3 отличника, на «4» и «5» успевают 5 человек, неуспевающих нет.
По уровню развития класс можно разделить на три группы:
67% - учащихся имеют высокий уровень развития: они быстро включаются в работу, обладают высоким уровнем объёма и концентрации внимания; способны легко переключаться на другие виды работ. У них развита наблюдательность, умение видеть и наблюдать признаки, анализировать, сравнивать, находить различия, классифицировать, обобщать, устанавливать причинно – следственные связи. У этих детей развиты почти все виды памяти: зрительная, слуховая, логическая. Быстро и прочно усваивается материал. Хорошо развита речь, богат словарный запас. Умеют чётко отвечать на вопросы и сами задают интересные вопросы. Имеют высокую учебную мотивацию.
25% - имеют средний уровень развития. У них процессы торможения преобладают над процессами возбуждения. Обладают высоким объёмом внимания, но имеют средний уровень концентрации внимания. Эти дети не сразу усваивают материал, им иногда требуется помощь учителя или одноклассника. Не всегда могут самостоятельно проанализировать, обобщить, сравнить, сделать выводы, установить причинно – следственные связи. У них больше развито практическое мышление. Эти дети меньше читают, но речь их хорошо развита, богатый словарный запас. Они умеют развёрнуто отвечать на вопросы, рассказывать, но творческие задания вызывают у них затруднения. Обладают средним уровнем обучаемости.
8% – дети с низким уровнем обучаемости. Они нуждаются в индивидуальной постоянной помощи со стороны учителя или одноклассника. Таких детей нужно постоянно контролировать. Эта группа детей плохо читает, затрудняются рассказать прочитанное, сделать выводы, проанализировать. Самостоятельно работать не могут совсем, выполняют только элементарные задания. Даже простые задачи по химии, в одно действие, они не могут выполнить, так как не знают таблицы умножения.
Класс в эмоционально – волевой сфере уравновешен. Ребята стремятся получать знания, переживают за успеваемость, выполняют все просьбы и требования учителя.
Цель урока носит триединый характер и состоит из трёх взаимодействующих аспектов:
познавательного, развивающего и воспитывающего. Эти аспекты цели определяют успешную реализацию основной функции урока.
Целями данного урока являются:
Образовательная:
1.Систематизировать имеющиеся знания о химических реакциях.
2.Закрепить представление о сущности химических реакций.
3.Повторить закономерности протекания химических реакций.
4.Обобщить сведения о типах химических реакций.
5.Продолжить формирование навыков:
Развивающая:
1.учебно-информационные навыки: умение извлекать информацию из устного сообщения, электронного документа, наблюдаемых процессов;
2.учебно-логические: умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы, формулировать определения понятий;
3.учебно-организационные: организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений
Воспитательная:
1.Совершенствовать коммуникативные умения в ходе выполнения опытов, развивать умение формулировать и аргументировать собственное мнение, развивать самостоятельность.
2.Продолжить формирование убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
Оборудование и реактивы: штатив с пробирками, растворы соляной кислоты, карбоната калия,
гидроксида натрия, фенолфталеина, хлорида меди(2), условные
знаки поездов (красный кружок и зелёный треугольник),
схема – конспект урока с заданиями, наградные знаки.
Система оценивания: на каждом этапе учащимся, выполнявшим задания у доски, а также на
своих рабочих местах, выдаются наградные знаки. К концу урока у ребят
накапливается определённое количество знаков, по которым легко оценить
работу: три знака – «5», два – «4», один – «3».
Ход урока
Девиз урока: «Достичь вершины – не свалиться в пропасть!»
Этапы урока с хронометражем:
1.Организационный 1мин.
2.Сообщение темы, цели урока 2 мин.
3.Актуализация знаний, умений и навыков. 5 мин.
4.Обобщение и систематизация понятий: 1 мин.
А) «шифровка» 6 мин.
Б) «угадай слово» 5 мин.
В) «письмо» 8 мин.
Г) «наскальные надписи» 5 мин.
5.Установление общих закономерностей 2 мин.
Д) «химический снегопад» 5 мин.
6. Домашнее задание 3 мин.
| Этапы урока | Деятельность учителя | Деятельность ученика |
Органи - зационный.
2. Сообщение темы, цели урока, мотивация учащихся.
3.Актуализация знаний, умений, навыков учащихся.
4. Обобщение и систематизация понятий.
5.Установление общих закономерностей.
6.Домашнее задание.
7.Подведение итогов.
| Приветствие: «Здравствуйте, ребята! Садитесь. Давайте улыбнемся друг другу, и начнём наш урок с хорошим настроением». Проверка готовности учащихся к уроку.
Эти явления знаете вы, В природе и в быту встречаются они, А отличают эти явления взаимные превращения, При которых образуются всегда новые вещества. Что же это за явления?
Тема нашего урока «Типы химических реакций». Сегодня на уроке мы должны систематизировать все полученные вами знания о химических реакциях, их типах и условиях протекания, для того, чтобы в дальнейшем вы могли правильно описывать химические свойства веществ, а также предсказывать возможности их получения. Кроме этого, хорошо овладев этой темой, вы без труда сможете осуществлять цепочки химических превращений, решать всевозможные химические задачи. А для этого мы с вами совершим восхождение к вершине горы. На горе вас ждет сюрприз,
Там еще и суперприз!
Чтобы гору перейти и к вершине нам дойти,
Нужно многое постичь, Надо много сил вложить:
Не бояться отвечать и вопросы задавать,
Уравнения химических реакций писать,
Знать, как их отличать,
Все задания выполнять, друг у друга проверять.
Цель свою тогда достигнем –
О типах реакций все постигнем! Девиз нашего урока – «Достичь вершины – не свалиться в пропасть!». Итак, в путь! Желаю удачи! Чтобы достичь цели, т.е. добраться до вершины горы, мы должны преодолеть 5 этапов: Шифровка Угадай слово Письмо Наскальные надписи Химический снегопад
Прежде, чем мы начнём путешествие по горам, нам надо добраться до их подножия. Предлагаю вам воспользоваться услугами химической железной дороги. В вашем распоряжении два вида поездов: скорый поезд (красный кружок); пассажирский поезд (зеленый треугольник). Ребята, какой из них быстрее?
В зависимости от уверенности в своих знаниях по изученным ранее темам, вы должны сейчас выбрать удобный для себя поезд. Посмотрите внимательно задания, написанные в схеме-конспекте нашего урока, и сделайте свой выбор. На столах у вас лежат условные знаки поездов, прошу поднять знак выбранного вами вида поезда. Фигуры не опускайте, т.к. я должен выбрать машинистов и дать им «руль» управления. Они будут выполнять задание у доски. Все остальные также должны выполнить задания на своих рабочих местах. Напоминаю, эти задания находятся в схеме-конспекте нашего урока. (два «машиниста» выполняют задание у доски)
Задание для пассажирского поезда. Запишите формулы веществ в соответствующие столбцы таблицы: H2, Na2S, Al, CuCl2, Mg, KI, S, Ca(OH) 2, O3, FeBr3 (табл. 1). | Простые вещества
| Сложные вещества
| | ____________________ | ______________________ | Задание для скорого поезда. Запишите формулы веществ в соответствующие столбцы таблицы: P2O5, I2, HNO3, Ca(OH)2, Na2O, K2SO4, Fe, H3PO4, N2, Na2SiO3, Cu, LiOH (табл. 2). | Простые вещества | Сложные вещества | | металлы | неметаллы | Оксиды | Основания | Кислоты | Соли | | ………. | ……….. | ……. | ……... | ……….. | ………..
| За выполненные задания пассажирского поезда ученики получают 2 балла, скорого – 3 балла. Ребята, давайте подведём итог нашей поездки и скажем, чем отличаются простые вещества от сложных, физические явления от химических? 1 ЭТАП «Шифровка» Начинаем выполнять восхождение в горы. На каждой парте лежит шифровка. Посмотрите на неё внимательно. В левой части листа записаны уравнения химических реакций, в правой – беспорядочно расставлены точки с цифрами; каждой цифре соответствует сумма коэффициентов в написанных в левом столбце уравнениях реакций. Ваша задача: расшифровать замаскированный химический элемент. Для этого необходимо по порядку уравнивать химические реакции, подсчитывать сумму коэффициентов в уравнении, находить соответствующие точки и последовательно с помощью маркеров соединять их друг с другом. Если вы правильно выполните задание, то узнаете, какой химический элемент спрятался за цифрами. 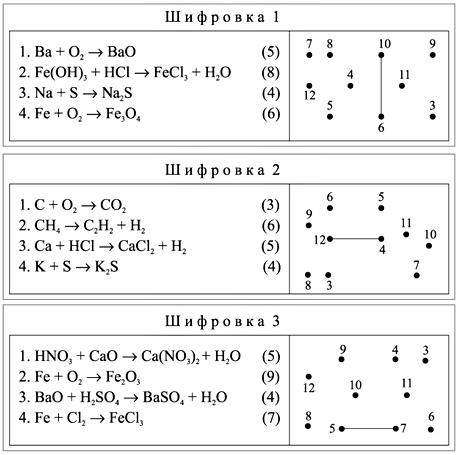 2 ЭТАП «Угадай слово» Учитель: Химических реакций известно в мире много,
И каждая в отдельности важна, поверьте мне.
Реакции мы делим на типы очень строго.
Какие это типы? Поведайте вы мне.
Что называется реакциями соединения, разложения, замещения, обмена?
Давайте выполним следующее задание: Задание.К какому типу химических реакций нужно отнести уравнения, приведенные в таблице «Угадай слово»? Необходимо правильно определить тип химической реакции, найти соответствующую букву, из букв сложить слово «Угадай слово»
| Уравнения реакций | Типы химических реакций | | соединения | разложения | замещения | обмена | | Mg + 2HCl = MgCl2 + H2 | Б | В | П | З | | 2Fe(OH) 3 = Fe2O3 + 3H2O | Г | И | К | Д | | 2Ca + O2 = 2CaO | С | Ж | С | Ф | | K3PO4 + 3AgNO3 = Ag3PO4 + 3KNO3 + 3KNO3 | Н | У | Т | Ь | | 2HgO = 2Hg + O2 | А | М | Р | П | | Br2 + 2KI = 2KBr + I2 | Ш | Л | О | И | Один человек работает у доски, остальные на своих местах. Учитель. Ребята, у кого получилось слово «Письмо», поднимите сигнальные карточки – зеленые треугольники – вверх. Друзья, вы правильно определили типы химических реакций, и мы получили название 3-го этапа нашего путешествия. А 2-й этап мы преодолели. 3 ЭТАП «Письмо» Учитель: Ребята, пока мы преодолевали этапы, нам по химической почте пришло видеописьмо. Давайте узнаем, что в нем. Это письмо от одного из персонажей пьесы Н.В. Гоголя «Ревизор», от Аммоса Федоровича Ляпкина-Тяпкина. Все знают этого судью, но не все знают, что он очень увлекается химией. Вот что он сообщает: «Многоуважаемые коллеги-химики 8 класса! Недавно я познакомился с одним из типов химических реакций – реакцией обмена. Несмотря на мои обширные познания в области химических наук,у меня возникла проблема – в моём распоряжении есть следующие реактивы – карбоната калия, соляной кислоты, хлорида меди(2) и гидроксида натрия. Все эти вещества сложные и должны вступать в реакции обмена, но на практике оказалось, что не все они взаимодействуют между собой. Почему? Помогите мне разрешить эту проблему. Буду вам премного благодарен. Искренне ваш коллега – Ляпкин-Тяпкин».
Учитель:Ну, что, ребята, поможем Ляпкину-Тяпкину разобраться с его проблемой? Но прежде чем мы начнем выполнять практическое задание, давайте разберемся: о каком типе химических реакций пишет Ляпкин-Тяпкин.
А при каких условиях проходят такие реакции?
Учитель: Если выделится газ – это раз,
И получится вода – это два,
А еще нерастворимый осаждается продукт.
«Есть осадок», – говорим мы.
Это третий важный пункт.
Химик правила обмена не забудет никогда. Задание. Давайте проведем лабораторные опыты, иллюстрирующие реакции обмена, и вы запишете соответствующие уравнения реакций с учетом правил написания реакций обмена в своих схемах-конспектах. И помните о правилах техники безопасности при выполнении лабораторных опытов – работаем аккуратно и с малым количеством реактивов. |
Уравнения реакций |
Условия | | HCL + K2CO3 —… |
|  HCL + NaOH |
|  CuCl2 + NaOH |
| Учитель:Итак, третий этап позади, мы помогли господину Ляпкину-Тяпкину разобраться в его проблеме. Но прежде чем мы перейдем к 4-му этапу, я предлагаю немного отдохнуть и устроить «стрельбу глазами». Задание «Стрельба глазами». 1. В периодической системе найдите самый активный элемент-неметалл. (F.) 2. Переведите свой взгляд влево, на элемент, стоящий в том же периоде в III группе. (B.) 3. Переведите взгляд вниз и влево, на самый активный металл. (Fr.) 4.Переведите взгляд вверх и вправо, на элемент, атомы которого образуют вещество, поддерживающее горение. (O.) 5.Переведите взгляд вниз и влево, на элемент, атомы которого образуют металл, используемый в градусниках. (Hg.) 6.Переведите взгляд вверх и вправо, на элемент с относительной атомной массой 35,5. (Cl.) 7.Переведите взгляд вниз и влево, на элемент, давший группе элементов название «лантаноиды». (La.) 8.Переведите свой взгляд вверх и вправо, на самый электроотрицательный элемент. (F.) 9.Переведите свой взгляд вниз и влево, на элемент, атомы которого образуют драгоценный металл желтого цвета. (Au.) 10. Переведите свой взгляд вверх на элемент, атомы которого образуют металл, занимающий первое место по электропроводности.(Аg)
4-й э т а п «Наскальные надписи» Учитель. На химической скале Чудо - надписи видны.
Разберём давайте с вами Что же тут зашифровали ?
.
Учитель. Задание. По данным надписям определить соответствующие химические реакции (табл. 5).
| Название реакции | Номер зашифрованной реакции | | Реакция соединения | | | Реакция разложения | | | Реакция замещения | | | Реакция обмена | | Учитель. Вот и 4-й этап позади (прикрепляет звездочку). Учитель: Друзья! Мы почти достигли цели. Впереди последний этап – «Химический снегопад». 5ЭТАП «Химический снегопад» Снег идет, и снег кружится.
Он ковром везде ложится.
Приглашаю всех я вас,
Поиграть в снежки сейчас. Ребята, мы с вами сейчас повторили и обобщили тему «Типы химических реакций», и я предлагаю вам оценить себя с помощью снежинок. Но снежинки у нас необыкновенные – химические. На снежинках разного цвета написаны задания разной степени трудности. Вы должны выбрать для себя задания по силам и на оценку, которая вас устраивает. Тексты с заданиями у вас записаны в схеме-конспекте. Задание на «3» «Синяя снежинка». Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакций. | Уравнение реакции | Тип химической реакции | | а) Al + Cr2O3 —Al2O3 + Cr | | | б) Li + N2 — Li3N | | | в) K2S + CuCl2 —CuS + KCl + KCl | | | г) N2O — N2 + O2 | |
Задание на «4» «Голубая снежинка». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций. | Уравнение реакции | Тип химической реакции | | а) Ca + Cl2 — .......... | | | б) HNO3 + Cu(OH) 2 — .......... | | | в) Mg + TiCl4 — .......... | | | г) AgBr — .................. | | Задание на «5» «Белая снежинка». Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций(табл. 8). | Уравнение реакции | Тип химической реакции | | а) Mg + O2 — .......... | | | б) Fe3O4 + Al — .......... | | | в) H3PO4 + HCl — .......... | | | г) Ba(OH)2 + H2SO4 — .......... | | | д) H2O — ............... | | Проводится проверка выполненных заданий. Учитель. Вот и все! (Прикрепляет последнюю звездочку.) Мы достигли цели! Кто-то из вас пришел к вершине горы без поражений, а кто-то был почти у края пропасти. Теперь давайте посмотрим, что же за сюрприз нас ожидает. На вершине горы – два конверта: «Сюрприз» и «Суперприз». Учитель вскрывает конверт «Сюрприз», в котором находятся кружочки с изображением отметок «3», «4», «5». Учитель. А теперь обмениваем заработанные вами баллы на оценки: 3 балла – одна «5»; 2 балла – одна «4». (Учитель раздает оценки.) А теперь, ребята, вспомните, какие слова были произнесены мною в самом начале урока?.. «На горе вас ждет сюрприз, там еще и суперприз…» Итак, суперигра! Принять участие в ней может тот, кто имеет не менее одной пятерки. Суперприз на горе.
Кто рискнет своей пятеркой,
Тот получит сразу две! Учитель вскрывает пакет «Суперприз» и читает задание. По тексту записать уравнение реакции: «Ты знаешь, газ мельчайший, водород В соединении с кислородом – это, Июньский дождь от всех своих щедрот Сентябрьские туманы на рассвете Учитель. В ваших схемах-конспектах записано домашнее задание, которое вы должны выполнить к следующему уроку. Каждый выбирает себе задание на ту оценку, которая его устраивает. Задание на «3» Тест Уровень А 1. Какой из признаков относится к признакам химической реакции: 1) испарение воды; 2) выделение газа; 3) плавление металла. 2. Какой из металлов не будет взаимодействовать с серной кислотой: 1) Cu; 2) Mg; 3) Zn; 4) Mn. 3. Реакция, протекающая по уравнению Cu + HgSO4 = CuSO4 + Hg относится к реакциям: 1) соединения; 2) разложения; 3) замещения; 4) обмена. 4. Коэффициент перед хлором в уравнении реакции: P + Cl2 = PCl5 равен: 1) 3; 2) 5; 3) 7; 4) 1. 5. Реакция, имеющая общий вид типа: АВ = А + В относится к реакциям: 1) соединения; 2) разложения; 3) замещения; 4) обмена. Уровень Б 6. Уравнение реакции, соответствующее описанию взаимодействия серной кислоты с гидроксидом натрия: 1) NaOH + H2SO4 = 2Na2SO4 + H2O; 2) Na2O + H2SO4= Na2SO4 + H2O; 3) 2NaOH + H2SO4 = Na2SO4+2H2O. 7. Сумма коэффициентов в уравнении реакции FeCl3 + Ca(OH)2 = Fe(OH)3 + CaCl2 равна: 1) 10; 2) 11; 3) 12; 4) 13. Задание на «4». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций | Уравнение реакции | Тип химической реакции | | а) AgI —……….. | Реакция…………….. | | б) MgO + H2SO4 —……….. | Реакция…………….. | | в) Al + HCl —……….. | Реакция…………….. | | г) Na + Cl2 —……….. | Реакция…………….. | Задание на «5». Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций. | Уравнение реакции | Тип химической реакции | | а) HNO3 + Mg (OH) 2 — ………..... | Реакция…………….. | | б) FeCl3 + Zn —……….. | Реакция…………….. | | в) CH4 —……….. | Реакция…………….. | | г) KOH + Ca (OH) 2 — ………..... | Реакция…………….. | | д) Ba + O2 —……….. | Реакция…………….. | Учитель. Сегодня на уроке мы систематизировали ваши знания по теме «Типы химических реакций». И я думаю, что в дальнейшем вам не составит труда описывать химические свойства веществ, осуществлять цепочки химических превращений, решать задачи. Спасибо вам за хорошую, плодотворную и интересную работу.
| Приветствуют учителя.
Ответ: химические реакции.
Ответ: скорый поезд.
Ученики выполняют задания на листах.
Учащиеся отвечают на вопросы.
Учащиеся выполняют задания.
Ответ: существует 4 типа химических реакций: реакции соединения, разложения, замещения, обмена.
Отвечают на поставленные вопросы.
Ответ: Реакции обмена. Ответ: если выделяется газ, вода, осадок.
Ребята выполняют лабораторную работу и записывают в тетради уравнения химических реакций.
Ученики делают задание на карточках.
Желающие работают у доски, остальные на своих местах пишут уравнения в схеме-конспекте.
Ученики записывают домашнее задание.
|
|
|
Приложение №1
Задание для пассажирского поезда. Запишите формулы веществ в соответствующие столбцы таблицы: H2, Na2S, Al, CuCl2, Mg, KI, S, Ca(OH) 2, O3, FeBr3 (табл. 1).
Таблица 1
| Простые вещества | Сложные вещества |
| ………………….. | ………………….. |
| ………………….. | ………………….. |
| ………………….. | ………………….. |
| ………………….. | ………………….. |
| ………………….. | ………………….. |
Задание для скорого поезда. Запишите формулы веществ в соответствующие столбцы таблицы: P2O5, I2, HNO3, Ca(OH)2, Na2O, K2SO4, Fe, H3PO4, N2, Na2SiO3, LiOH, Cu
Таблица 2
| . Простые вещества | Сложные вещества |
| металлы | неметаллы | оксиды | основания | кислоты | соли |
| ……… | ……… | ……… | ……… | ……… | ……… |
Приложение №2
Приложение № 3
| Уравнения реакций | Условия |
| HCL + K2CO3 —… |
|
 HCL + NaOH |
|
 CuCl2 + NaOH |
|
Приложение №4

| Название реакции | Номера зашифрованных реакций. |
| Реакция соединения | |
| Реакция разложения | |
| Реакция замещения | |
| Реакция обмена | |
Приложение №5
Задание на «3» «Синяя снежинка». Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Al + Cr2O3 —Al2O3 + Cr | |
| б) Li + N2 — Li3N | |
| в) K2S + CuCl2 —CuS + KCl + KCl | |
| г) N2O — N2 + O2 | |
Задание на «4» «Голубая снежинка». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Ca + Cl2 — .......... | |
| б) HNO3 + Cu(OH) 2 — .......... | |
| в) Mg + TiCl4 — .......... | |
| г) AgBr — .................. | |
Задание на «5» «Белая снежинка». Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций(табл. 8).
| Уравнение реакции | Тип химической реакции |
| а) Mg + O2 — .......... | |
| б) Fe3O4 + Al — .......... | |
| в) H3PO4 + HCl — .......... | |
| г) Ba(OH)2 + H2SO4 — .......... | |
| д) H2O — ............... | |
Домашнее задание
Задание на «3»
Уровень А
1. Какой из признаков относится к признакам химической реакции:
1) испарение воды; 2) выделение газа; 3) плавление металла.
2. Какой из металлов не будет взаимодействовать с серной кислотой:
1) Cu; 2) Mg; 3) Zn; 4) Mn.
3. Реакция, протекающая по уравнению Cu + HgSO4 = CuSO4 + Hg относится к реакциям:
1) соединения; 2) разложения; 3) замещения; 4) обмена.
4. Коэффициент перед хлором в уравнении реакции: P + Cl2 = PCl5 равен:
1) 3; 2) 5; 3) 7; 4) 1.
5. Реакция, имеющая общий вид типа: АВ = А + В относится к реакциям:
1) соединения; 2) разложения; 3) замещения; 4) обмена.
Уровень Б
6. Уравнение реакции, соответствующее описанию взаимодействия серной кислоты с гидроксидом натрия:
1) NaOH + H2SO4 = 2Na2SO4 + H2O;
2) Na2O + H2SO4= Na2SO4 + H2O;
3) 2NaOH + H2SO4 = Na2SO4+2H2O.
7. Сумма коэффициентов в уравнении реакции FeCl3 + Ca(OH)2 = Fe(OH)3 + CaCl2 равна:
1) 10; 2) 11; 3) 12; 4) 13.
Задание на «4». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций
| Уравнение реакции | Тип химической реакции |
| а) AgI —……….. | Реакция…………….. |
| б) MgO + H2SO4 —……….. | Реакция…………….. |
| в) Al + HCl —……….. | Реакция…………….. |
| г) Na + Cl2 —……….. | Реакция…………….. |
Задание на «5». Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций
| Уравнение реакции | Тип химической реакции |
| а) HNO3 + Mg (OH) 2 — ………..... | Реакция…………….. |
| б) FeCl3 + Zn —……….. | Реакция…………….. |
| в) CH4 —……….. | Реакция…………….. |
| г) KOH + Ca (OH) 2 — ………..... | Реакция…………….. |
| д) Ba + O2 —……….. | Реакция…………….. |
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ ДЛЯ УЧИТЕЛЯ.
| 1.Денисова В.Г. Химия 8-11 классы: Открытые уроки. – Волгоград: Учитель, 2003г. |
| 2. Химия и экология. 8-11 классы: Материалы для проведения учебной и внеурочной работы по экологическому воспитанию/ сост. Г. А. Фадеева. – Волгоград: Учитель, 2005г. |
| 3.Брейгер Л.М. Химия. Уроки-семинары в 9 классе по отдельным темам программы. –Волгоград: Учитель, 2003г. |
| 4.Зуева М.В., Гара Н.Н. Школьный практикум. Химия. 8 -9 кл. – М.: Дрофа,1999г. |
| 5.Мезенин Н.А. Занимательно о железе. – М.: Металлургия, 2005г. (Научно – популярная библиотека школьника) |
| 6.Химия. 8,10,11 классы: Нестандартные уроки/ авт.-сост. Л. М. Брейгер. - Волгоград: Учитель, 2004г. |
| 7.Нестандартные уроки химии. 10 класс./ Сост. Бочарова С.В. – Волгоград: ИТД «Корифей», 2006г. |
| 8.Горковенко М.Ю. Химия. 8 класс: Поурочные разработки к учебникам О. С. Габриеляна; Л. С. Гузея, В. В. Сорокина, Р. П. Суровцевой; Г. Е. Рудзитиса, Ф.Г .Фельдмана. – М.: ВАКО,2004 г. |
| 9.О. С. Габриелян, Н. Н. Воскобойникова, А. В. Яшукова. Настольная книга учителя. Химия 8 класс. М.: Дрофа, 2003г. |
| 10. О. С. Габриелян, И. Г. Остроумов. Настольная книга учителя. Химия 9 класс. М.: Дрофа, 2003г. |
| 11. О. С. Габриелян, И. Г. Остроумов. Настольная книга учителя. Химия 10 класс. М.: Дрофа, 2004г. |
| 12. О. С. Габриелян, Г. Г. Лысова, А. Г. Введенская. Настольная книга учителя. Химия 11 класс в двух частях. М.: Дрофа, 2004г. |
| 13. М. В. Зуева, Н. Н. Гара. Контрольные и проверочные работы по химии 8—9 классы. М.: Дрофа, 2001г. |
| 14. М. В. Зуева, Н. Н. Гара. Контрольные т проверочные работы по химии 10--11 классы. М.: Дрофа, 2001г. |
| 15. Горковенко М.Ю. Поурочные разработки по химии к учебным комплектам О. С. Габриеляна и др., Л. С. Гузея и др., Г. Е. Рудзитиса и др. 10 (11) класс. – М.: ВАКО,2006 г. |
| 16. Химия. 11 класс: Поурочные планы. По учебнику: Габриелян О.С., Лысова Г.Г. Химия,11 класс/ Авт. – Сост. Денисова В. Г. – Волгоград: Учитель, 2003 г. |
| 17.Троегубова Н.П. Поурочные разработки по химии: 11 класс. – М.: ВАКО, 2009 г. |
| 18.Габриелян О. С. Химия 8-11 класс. Методическое пособие. - М., Дрофа, 2001г. 19. Тарасов А.К.Веселый урок по химии.– Смоленск. Русич,2000г.
|
| 20. Денисова В. Г.Открытые уроки по химии. - Волгоград., Учитель, 2003г.
|
| 21. Калейдоскоп учебно-деловых игр в старших классах. /Авт.- Сост. В. М. Симонов. М.: Дрофа, 2005 г. |
| 22. Пособие для учителя химии по планированию учебного материала в старших классах. - автор Габриелян О.С.,М.:Дрофа,2001 год.
|
| 23. Контрольные и проверочные работы по химии 8-11класс. - М.: Дрофа,1997г.
|
| 24. Химия. Предметная неделя в школе: планы и конспекты мероприятий. /Авт. - Сост. Л. В. Волынова и др. - Волгоград: Учитель, 2005г.
|
18









 9 класс 10 класс
9 класс 10 класс
 о химических реакциях в органической химии
о химических реакциях в органической химии 




















