Урок химии в 11 классе по теме «Окислительно-восстановительные реакции»
Дидактические цели:
Образовательные: обобщить, систематизировать и расширить знания учащихся об окислительно-восстановительных реакциях, важнейших окислителях и продуктах их восстановления.
Развивающие: способствовать формированию и развитию самостоятельности и познавательного интереса учащихся к предмету.
Воспитательные: способствовать формированию и развитию нравственных, трудовых, экономических и других качеств личности, воспитанию правильного отношения к общечеловеческим ценностям.
Задачи урока:
Образовательные:
закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса;
совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора;
показать разнообразие и значение окислительно-восстановительных реакций (ОВР) в природе и повседневной жизни;
продолжить подготовку к ЕГЭ по химии.
Развивающие:
способствовать развитию речи учащихся, формированию умения анализировать, сопоставлять и обобщать знания по теме;
развивать мыслительные процессы (анализ, синтез, сравнение, обобщение, классификация).
Воспитательные: воспитывать осознанную потребность в знаниях, совершенствовать умение выслушивать мнение каждого члена коллектива.
Оборудование и реактивы:
Тип урока: усвоение новых знаний с применением имеющихся знаний и умений с последующим обобщением и систематизацией.
Методы: словесные, наглядные, практические, частично-поисковые.
Ход урока:
Организационный момент
I. Мотивационно-ориентировочный этап
Эпиграф к уроку:
«Кто-то теряет, а кто-то находит…»
Сегодня на уроке, ребята, мы будем говорить о реакциях, которые сопровождают многие процессы, осуществляемые в промышленности и в различных сферах быта: получение металлов и производство пластмасс, горение газа в газовой плите и топлива в двигателе внутреннего сгорания, приготовление пищи и фотосинтез, стирка одежды и дыхание, дезинфекция и брожение глюкозы… Что же это за реакции, ребята, которые чрезвычайно распространены в природе и технике? ОВР.
Формулировка темы урока. Формулировка цели урока: расширить и углубить знания по составлению уравнений ОВР методом электронного баланса.
II. Операционно-исполнительский этап
Предлагаю вам по вариантам осуществить практически некоторые химические реакции:
1 вариант: взаимодействие раствора хлорида бария с раствором серной кислоты
2 вариант: взаимодействие раствора сульфата меди (II) с раствором гидроксида натрия
Запишите уравнения проделанных вами реакций.
Являются ли эти реакции ОВР? (Нет.) Почему? (Не происходит изменения степеней окисления атомов, входящих в состав веществ.)
Значит, какое определение мы можем дать ОВР? – Реакции, идущие с изменением ст. ок. атомов, входящих в состав веществ.
Обратимся к эпиграфу урока: Кто-то теряет, а кто-то находит…». Как вы думаете, ребята, почему в качестве эпиграфа к нашему уроку я выбрала слова из известной песни Э.Пьехи?
В ОВР есть вещество, которое теряет электроны – восстановитель (процесс окисления), есть вещество, которое находит (принимает) электроны – окислитель (восстановление). Эти процессы связаны друг с другом.
Выполнение заданий по материалам ЕГЭ (задание 19).
1 вариант
Установите соответствие между схемой реакции и формулой вещества-восстановителя в ней:
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВОССТАНОВИТЕЛЯ |
| А) Cl2 + KOH → KCl + KClO + H2O | 1) KOH |
| Б) H2O2 + Ag2O → H2O + Ag + O2 | 2) Cl2 |
| В) H2O2 + Cl2 → HCl + O2 | 3) H2O2 |
| 4) Ag2O |
2 вариант
Установите соответствие между схемой реакции и изменением степени окисления окислителя в данной реакции:
| СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ |
| А) P + HNO3 → H3PO4 + NO2 + H2O | 1) +5 → +2 |
| Б) Cu + KNO3 + H2SO4 → → CuSO4 + NO + K2SO4 + H2O | 2) +5 → -3 |
| 3) +5 → +1 |
| В) Zn + HNO3 → Zn(NO3)2 + N2O + H2O | 4) +5 → +4 |
Ребята, давайте попробуем вспомнить и определить, какие из веществ, указанных на экране, могут быть только окислителями в ОВР, какие только восстановителями, а какие проявляют двойственные свойства? И почему?
Группы веществ на экране:
Сu, Zn, Ca и другие металлы (только восстановители, низшая ст.ок.)
KMnO4, K2Cr2O7, HNO3, H2SO4 (конц.) (только окислители, высшая ст.ок.)
Сl2, Br2, I2 (преимущественно окислители, но могут проявлять и свойства восстановителей, промежуточная ст.ок.)
HI, Na2S, NH3, KBr, HCl (только восстановители, низшая ст.ок.)
СO, Na2SO3, KNO2, Cu2O, H2O2 (преимущественно восстановители, но могут проявлять свойства окислителей, промежуточная ст.ок.).
Предлагаю вам, используя инструкции, проделать ОВР и, используя памятки, записать схемы этих реакций, а затем, используя алгоритм составления уравнений ХР методом электронного баланса, расставить коэффициенты в уравнениях ОВР.
1 реакция (работа ученика у доски):
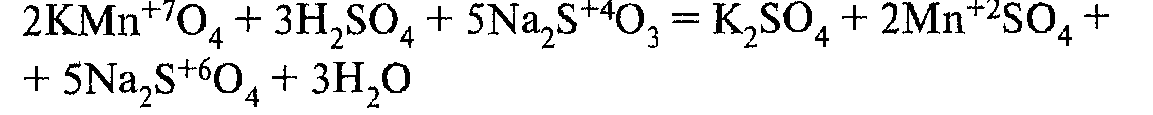
2 реакция (работа ученика у доски):
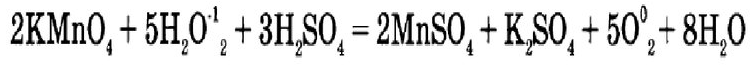
В зависимости от того, в каких веществах располагаются элементы окислитель и восстановитель, ОВР подразделяются на три типа:
1) межмолекулярные
2) внутримолекулярные
3) р. диспропорционирования
Их описания даны у вас в рабочих листах и на экране.
III. Оценочно-рефлексивный этап
Ребята, я предлагаю вам выполнить интересное задание: ознакомьтесь с предложенным текстом, установите, о каких веществах идёт речь, составьте уравнения всех ОВР, описанных в тексте, и укажите их тип. Для составления уравнений ОВР пользуйтесь памятками.
И сследуемый газ желтовато-зеленоватого цвета является сильным окислителем, используется для стерилизации чистой воды и обеззараживания сточных вод. Он разрушает многие краски, на чём основано его применение при белении бумаги и тканей. Этот газ стал первым смертоносным газом, использованным Германией во время Первой мировой войны в качестве отравляющего средства против французских войск. В лаборатории данный газ получают взаимодействием твёрдого перманганата калия с 20%-ным раствором соляной кислоты.
сследуемый газ желтовато-зеленоватого цвета является сильным окислителем, используется для стерилизации чистой воды и обеззараживания сточных вод. Он разрушает многие краски, на чём основано его применение при белении бумаги и тканей. Этот газ стал первым смертоносным газом, использованным Германией во время Первой мировой войны в качестве отравляющего средства против французских войск. В лаборатории данный газ получают взаимодействием твёрдого перманганата калия с 20%-ным раствором соляной кислоты.
Е сли полученный газ пропустить через охлаждённый льдом раствор гидроксида натрия, то его желтовато-зелёная окраска исчезает, и в ходе реакции образуется вещество, входящее в состав бытового средства для дезинфекции и отбеливания под названием «Белизна». Обращаться с ним нужно крайне осторожно, обязательно работать в резиновых перчатках, так как это средство имеет сильно выраженную щелочную реакцию. Такой отбеливатель эффективен только в холодной воде, так как при нагревании он разрушается (разлагается) с образованием двух новых веществ.
сли полученный газ пропустить через охлаждённый льдом раствор гидроксида натрия, то его желтовато-зелёная окраска исчезает, и в ходе реакции образуется вещество, входящее в состав бытового средства для дезинфекции и отбеливания под названием «Белизна». Обращаться с ним нужно крайне осторожно, обязательно работать в резиновых перчатках, так как это средство имеет сильно выраженную щелочную реакцию. Такой отбеливатель эффективен только в холодной воде, так как при нагревании он разрушается (разлагается) с образованием двух новых веществ.
Если вместо едкого натра взять едкое кали, то при пропускании через его горячий раствор исследуемого газа образуется бертолетова соль. При охлаждении соль кристаллизуется в виде блестящих пластинчатых кристаллов. Раньше её использовали для получения кислорода путём разложения при нагревании в присутствии катализатора диоксида марганца.
Проверьте правильность выполнения работы на экране, подсчитайте общее количество баллов и оцените свою работу на уроке.






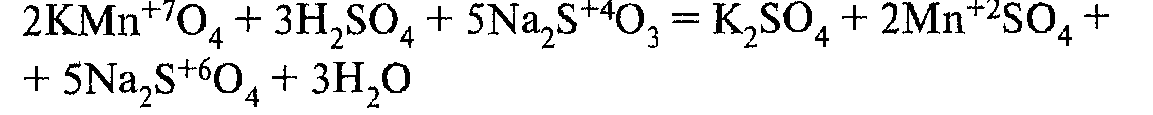
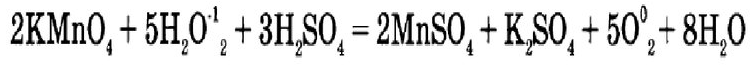
 сследуемый газ желтовато-зеленоватого цвета является сильным окислителем, используется для стерилизации чистой воды и обеззараживания сточных вод. Он разрушает многие краски, на чём основано его применение при белении бумаги и тканей. Этот газ стал первым смертоносным газом, использованным Германией во время Первой мировой войны в качестве отравляющего средства против французских войск. В лаборатории данный газ получают взаимодействием твёрдого перманганата калия с 20%-ным раствором соляной кислоты.
сследуемый газ желтовато-зеленоватого цвета является сильным окислителем, используется для стерилизации чистой воды и обеззараживания сточных вод. Он разрушает многие краски, на чём основано его применение при белении бумаги и тканей. Этот газ стал первым смертоносным газом, использованным Германией во время Первой мировой войны в качестве отравляющего средства против французских войск. В лаборатории данный газ получают взаимодействием твёрдого перманганата калия с 20%-ным раствором соляной кислоты. сли полученный газ пропустить через охлаждённый льдом раствор гидроксида натрия, то его желтовато-зелёная окраска исчезает, и в ходе реакции образуется вещество, входящее в состав бытового средства для дезинфекции и отбеливания под названием «Белизна». Обращаться с ним нужно крайне осторожно, обязательно работать в резиновых перчатках, так как это средство имеет сильно выраженную щелочную реакцию. Такой отбеливатель эффективен только в холодной воде, так как при нагревании он разрушается (разлагается) с образованием двух новых веществ.
сли полученный газ пропустить через охлаждённый льдом раствор гидроксида натрия, то его желтовато-зелёная окраска исчезает, и в ходе реакции образуется вещество, входящее в состав бытового средства для дезинфекции и отбеливания под названием «Белизна». Обращаться с ним нужно крайне осторожно, обязательно работать в резиновых перчатках, так как это средство имеет сильно выраженную щелочную реакцию. Такой отбеливатель эффективен только в холодной воде, так как при нагревании он разрушается (разлагается) с образованием двух новых веществ.









