ПЛАН УРОКА
| Специальность/профессия | 35.01.19 Мастер садово-паркового и ландшафтного строительства |
| УД / МДК/ ПМ | ОУД.09. Химия |
| Преподаватель | Устяхина О.Ф. |
| Место проведения | Кабинет 219 ГБПОУ РХ ХКПТЭС |
| Группа | М-18 | курс | первый |
| Время урока | 09.50-10.35 | количество обучающихся | 29 |
| Тема раздела | Раздел 1. Общая и неорганическая химия |
| Тема урока | Атом – сложная частица. Строение атомного ядра |
| Вид урока | Смешанный урок (сочетание различных видов на одном уроке) |
| Тип урока | Урок изучения нового материала |
| Педагогическая технология или методическая цель | Разноуровневое обучение; технология игрового обучения: ролевых, обучающих игр |
| Цель урока: | Формирование понятия об атоме и атомном ядре, обеспечение усвоения учебного материала обучающимися в процессе активной мыслительной деятельности с разными источниками информации |
| К концу занятия каждый обучающийся будет: | что будет способствовать формированию и развитию основных образовательных результатов |
|
| • личностных: ЛР1 чувство гордости и уважения к истории и достижениям отечественной химической науки; ЛР3 умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности; • метапредметных: МР1 использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания для изучения различных сторон химических объектов и процессов; МР2 использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере; • предметных: ПР1 сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач; ПР2 владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой; ПР3 владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением; умение обрабатывать, объяснять результаты и делать выводы; готовность и способность применять методы познания при решении практических задач; ПР4 сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям; ПР6 сформированность собственной позиции по отношению к химической информации, получаемой из разных источников; СПР1 овладение основными доступными методами научного познания; СПР2 адекватное использование компенсирующей нарушение зрения техники и средств в соответствии с коммуникативной ситуацией.
|
| Организация пространства |
| Ресурсы: ноутбук, телевизор, Периодическая система химических элементов Д.И. Менделеева, опорные листы, рабочие листы, рефлексивные листы.
Приложения: МП.1 – мультимедийная презентация; РЛ.2 – рабочие листы; ОЛ.3 – опорные листы; РЛ.4 – рефлексивные листы. | Новые термины и понятия: атом, протоны, нейтроны, электроны, химический элемент, изотопы | Межпредметные связи: ОУД.08. Физика (включая Астрономию). Раздел 6. Элементы квантовой физики. Тема 6.2. Физика атома. Тема 6.3. Физика атомного ядра. |
Ход урока
1. Организационный момент. Приветствие обучающихся, гостей. На рабочих столах студентов находятся рабочие, опорные и рефлексивные листы; у студента с ОВЗ – адаптированные рабочие, опорные и рефлексивные листы. На экране анимационная заставка «Строение атома» (слайд 1 (приложение 1)).
2. Ориентировочно-мотивационный.
Преподаватель:
Вспомните, что изучает химия?
Из чего состоят вещества?
Что такое химический элемент?
Итак, мы знаем, что мельчайшей частицей вещества является атом, атомы одного вида, называются химическим элементом (запись в рабочем листе в разделе «Знаем» (приложение 2)).
Понятие «атом» пришло к нам из античности и связано с именем древнегреческого философа Демокрита, в переводе с греческого «атом» означает «неделимый» (слайд 2 (приложение 1)). Так ли это?
Прочтите поэтические строчки (слайд 3 (приложение 1), опорный лист 1 (приложение 3)):
Элементы встали вряд,
В ядрах их растет заряд.
Значит столько в нем протонов,
А в округе – электронов.
Есть в ядре еще нейтроны,
Что заряд иметь не склонны.
Ну а то, что в массе дробь,
В том виновен изотоп.
1. Что вы узнали из поэтических строк?
2. Смысл каких слов вам не понятен?
3. Как вы думаете, о чем сегодня на уроке пойдет речь?
4. Найдите в прочитанных строках в состав чего входят протоны, электроны, нейтроны?
5. Сформулируйте тему урока («Атом – сложная частица. Строение атомного ядра» – слайд 4 (приложение 1), запись темы на доске и рабочем листе (приложение 2)).
6. Какова цель урока (слайд 5 (приложение 1), запись в рабочем листе в разделе «Хотим узнать» (приложение 2))?
3. Актуализация знаний, проверка домашнего задания (домашнее задание с опережением): История изучения состава атома.
Преподаватель: В истории развития физики одной из самых интересных и увлекательных страниц является история открытия сложного строения атома, с которой мы кратко познакомимся, прослушав сообщения студентов. В начале века бытовали самые разные и часто фантастические представления о строении атома, которые не нашли четкого обоснования и лишь модель атома, предложенная Джозефом Томсоном на долгие годы закрепилась в науке.
Обучающийся 1 (сообщение): Джозеф Томсон – английский физик, открывший электрон, лауреат Нобелевской премии по физике. В 1904 году предложил модель атома, согласно которой, вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны «вкраплены» в атом, словно изюмины в булку. Модель так и назвали «ПУДИНГ С ИЗЮМОМ», но эта модель не была подтверждена экспериментальными фактами и осталась гипотезой (слайд 6 (приложение 1)).
Преподаватель: Учеником Джозефа Томсона был Эрнест Резерфорд.
Обучающийся 2 (сообщение): Эрнест Резерфорд в 1911 году, исследовав состав и строение атома на основе радиоактивности, доказывавшей сложность строения атома, предложил ядерную (планетарную) модель атома (слайд 7 (приложение 1)). Резерфорд являлся членом Лондонского королевского общества, почетным членом 30 Академий наук, в том числе и Советской Академии наук. В 1908 году удостоен Нобелевской премии за исследование радиоактивности. Его учениками были: Чедвик, Бор, советский физик Петр Капица и другие.
Преподаватель: Позже в 1913 году датский физик Нильс Бор внес квантовые представления в строение атома, а в 1932 году была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов и нейтронов. Обобщая сказанное, какой вывод мы можем сделать?
Обучающиеся: В начале 20 века разрушились представления о неделимости атома. Атом – сложная частица.
4. Операционно-исполнительский этап (работа в парах и индивидуальная работа).
Преподаватель: Используя схему строения атома (слайд 8 (приложение 1), опорный лист 2 (приложение 3)) и таблицу «Основные характеристики некоторых элементарных частиц» (слайд 9 (приложение 1), опорный лист 3 (приложение 3)), докажите сложность строения атома, для этого выполните задание 1 в рабочем листе (приложение 2), где необходимо вставить пропущенные слова в тексте:
1. Атом – это частица, состоящая из _____________________________________________________.
2. В состав ядра атома входят ________________ и _________________.
3. Протон – элементарная частица, имеющая массу приблизительно ___ и заряд равный ___. Для протона принято обозначение ____.
4. Ядро атома имеет _________________ заряд.
5. Нейтрон – элементарная частица, имеющая массу приблизительно ___ и заряд равный ___. Для нейтрона принято обозначение ___.
6. Вокруг ядра постоянно движутся _____________, их заряд – ___, а масса – ___.
7. Масса атома сосредоточена в ______________, т.к. массой ___________ можно пренебречь.
8. Атом электронейтрален, т.к. _________________________________________________________.
9. По разности _______________________________________ определяют число нейтронов в атоме.
Преподаватель: Что у вас получилось? (Устные ответы обучающихся, выполнивших задание 1). Предлагаю вам записать определение атома (слайд 10 (приложение 1) в рабочие листы в раздел «Узнали» (приложение 2)).
Атом – это электронейтральная система взаимодействующих элементарных частиц, состоящая из положительно заряженного ядра (образованного протонами и нейтронами) и отрицательно заряженных электронов. Атом – наименьшая химически неделимая частица.
Преподаватель: Как вы понимаете задание: определить состав атома? Рассмотрите алгоритм, позволяющий вам определить состав атома (слайд 11 (приложение 1), опорный лист 4 (приложение 3):
1. N = – см. ПСХЭ
2. N = Z = число р+
3. Число n0 = Ar – Z
4. Число ē = числу р+
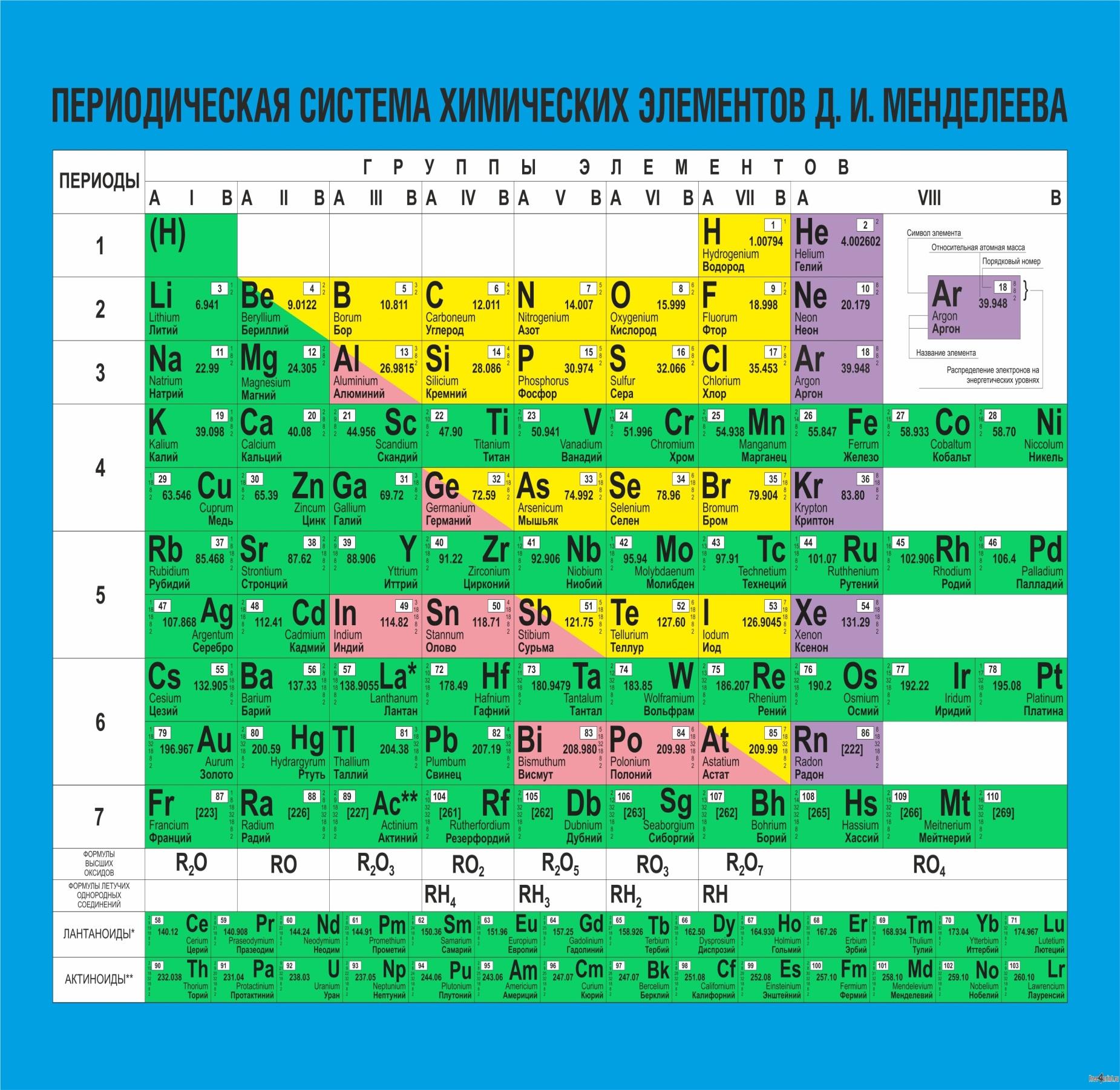
Преподаватель: Используя данный алгоритм и Периодическую систему химических элементов Д.И. Менделеева (слайд 12 (приложение 1), опорные листы 4, 5 (приложение 3)), выполните задание 2: заполните таблицу в рабочем листе (работа по вариантам, обучающийся с нарушением зрения выполняет одно задание по выбору).
| Вариант | Знак химического элемента | Название | Число протонов | Число нейтронов | Число электронов |
| 1 | S | Сера | 16 | 16 | 16 |
| Аl | Алюминий | 13 | 14 | 13 |
| 2 | Si | Кремний | 14 | 14 | 14 |
| Са | Кальций | 20 | 20 | 20 |
| Итого, общее количество баллов: |
Подводится итог (слайд 13 (приложение 1): за правильно выполненное задание выставляются баллы (взаимопроверка в парах, обучающийся с нарушением зрения осуществляет самопроверку).
Критерии оценки: без ошибок – молодец (5б.), 1–2 ошибки – не все потеряно (4-3б.), 3–4 ошибки – стоит обратить на это особое внимание (0б.).
Преподаватель: Мы знаем, что свободные атомы – это одна из форм существования химического элемента. В настоящее время известно 118 химических элементов. Давайте обратимся к Периодической системе химических элементов Д.И. Менделеева и посмотрим, какими числами представлены в ней относительные атомные массы элементов (опорный лист 5 (приложение 3))? Если масса атома определяется количеством протонов и нейтронов, массы которых выражены целыми числами, то почему относительные атомные массы представляют собой дробные величины? (Постановка учебной проблемы.) На эти вопросы мы будем искать ответы в ходе мысленного эксперимента (решение задачи и оформление результатов эксперимента).
Решение задачи: Что произойдет с атомами одного и того же вида, если в их ядра мысленно добавить по 1 нейтрону? Для примера возьмем атом с самым простым строением – атом водорода.
Найдите в Периодической системе химический элемент Водород. Сколько протонов содержит его атом? (Один). Эта разновидность атома носит название протий (из-за простоты строения).
Мысленно добавьте в этот атом 1 нейтрон. Изменилась ли масса атома? (Да, она равна массе протона и нейтрона, массу электрона из-за ее очень малой величины не учитываем).
Сравните строение ядра протия и полученного атома. Такой атом водорода называют дейтерием.
Мысленно добавьте теперь уже в ядро дейтерия один нейтрон. (Дальнейшие рассуждения аналогичны вышеизложенным). Полученный атом называют тритием.
Итак, получили три разновидности атомов водорода с различными массами (слайд 14 (приложение 1), опорный лист 6 (приложение 3)).
Как же называют разновидности атомов одного и того же вида (в нашем случае – атомов водорода), имеющие один и тот же заряд ядра атома, но разные массы? Взгляните, в Периодической системе всем разновидностям атома водорода отведено одно и то же место. Поэтому, они получили название изотопы («изос» – равный, одинаковый, «топос» – место), т. е. занимающие одно и то же место.
Оформление результатов мысленного эксперимента (формулировка понятия «изотопы»).
Изотопы – это разновидности атомов одного и того же химического элемента имеющие одинаковый заряд атомного ядра, но разные массовые числа (слайд 15 (приложение 1), запись в рабочем листе в разделе «Узнали» (приложение 2)).
Преподаватель: Почему же относительные атомные массы элементов в Периодической системе не целые, а дробные величины?
Обучающиеся: Это средняя арифметическая величина, в которой учтены не только массы всех изотопов, но еще и процентное содержание в природе. Поэтому получаемые при расчетах величины оказываются не целыми, а дробными.
Преподаватель: Давайте разберемся, какая частица в атоме главная? (Постановка учебной проблемы, решение которой основывается на известной студентам информации).
Нейтрон? Нет, их количество может быть разным.
Электрон? Нет, они могут быть отданы или приняты в ходе химических превращений.
Относительная атомная масса? Нет, она может быть различной.
Преподаватель: Главной характеристикой любого химического элемента является значение положительного заряда ядра атома, определяемое числом протонов.
Преподаватель: Исходя из этого, попробуйте дать современное, определение понятию «химический элемент».
Обучающиеся: Химический элемент – это совокупность атомов с одинаковым зарядом ядра (слайд 16 (приложение 1), продолжение записи в рабочем листе в разделе «Узнали» (приложение 2)).
Преподаватель: Подведем итог. Проанализируем записи в рабочих листах вначале и конце урока в разделах: Знали. Хотели узнать. Узнали (устные ответы студентов).
5. Диагностика и коррекция первичного усвоения материала.
Проведем игру «Верю – не верю» (слайд 17 (приложение 1)).
Верите ли вы, что:
1. Только электроны входят в состав атома?
2. Электроны, положительно заряженные частицы?
3. Количество нейтронов и электронов одинаковое?
4. Атомная масса равна количеству нейтронов?
5. У всех элементов одинаковое строение атома?
6. Число протонов в атоме водорода равно 2?
Преподаватель подводит итоги урока, проверяет цель урока, оценивает работу групп и отдельных обучающихся (подводятся итоги в рабочих листах студентов).
Преподаватель: В завершении урока прошу в рефлексивных листах (приложение 4) подписать фамилию, имя и обвести одну из четырех цифр: 1. Было несложно, интересно; 2. Было сложно, но интересно; 3. Было сложно, неинтересно; 4. Другое.
6. Домашнее задание (слайд 18 (приложение 1)).
Выполните задание по выбору:
Используя изученные на уроке термины, составьте кроссворд по теме «Атом – сложная частица. Строение атомного ядра».
Напишите небольшую сказку, рассказ, эссе, детектив или другое на тему «Атом похож …».
Приложение 2. Рабочий лист
Тема урока _______________________________________________________________________________
Дата урока _______________________________________________________________________________
ФИО ____________________________________________________________________________________
| Знаем | Хотим узнать | Узнали |
|
|
|
|
Задание 1. Докажите сложность строения атома, для этого вставьте пропущенные слова в тексте, используя опорные листы 2, 3:
1. Атом – это частица, состоящая из _____________________________________________________.
2. В состав ядра атома входят ________________ и _________________.
3. Протон – элементарная частица, имеющая массу приблизительно ___ и заряд равный ___. Для протона принято обозначение ____.
4. Ядро атома имеет _________________ заряд.
5. Нейтрон – элементарная частица, имеющая массу приблизительно ___ и заряд равный ___. Для нейтрона принято обозначение ___.
6. Вокруг ядра постоянно движутся _____________, их заряд – ___, а масса – ___.
7. Масса атома сосредоточена в ______________, т.к. массой ___________ можно пренебречь.
8. Атом электронейтрален, т.к. _________________________________________________________.
9. По разности _______________________________________ определяют число нейтронов в атоме.
Задание 2. Используя алгоритм (опорный лист 4) и Периодическую систему химических элементов Д.И. Менделеева (опорный лист 5), заполните таблицу (работа по вариантам, обведите свой вариант), а затем передайте выполненное задание соседу и осуществите взаимопроверку.
| Вариант | Знак химического элемента | Название | Число протонов | Число нейтронов | Число электронов |
| 1 | S |
|
|
|
|
|
| Алюминий |
|
|
|
| 2 |
|
| 14 |
|
|
|
|
|
|
| 20 |
| Итого, общее количество баллов: |
Критерии оценки: без ошибок – молодец (5б.), 1–2 ошибки – не все потеряно (4-3б.), 3–4 ошибки – стоит обратить на это особое внимание (0б.).
Вывод:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Оценка за урок___________.
Приложение 3. Опорные листы
Опорный лист 1
Элементы встали вряд,
В ядрах их растет заряд.
Значит столько в нем протонов,
А в округе – электронов.
Есть в ядре еще нейтроны,
Что заряд иметь не склонны.
Ну а то, что в массе дробь,
В том виновен изотоп.
Опорный лист 2
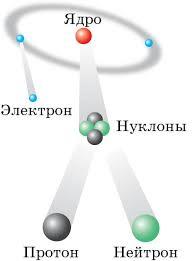
Рисунок 1. Схема строения атома
Опорный лист 3
Таблица 1. Основные характеристики некоторых элементарных частиц
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон, р+ | 1 | +1 | Число протонов равно порядковому номеру элемента в таблице Д.И. Менделеева |
| Нейтрон, n0 | 1 | 0 | Число нейтронов находят по формуле N(n0) = А – Z, где А – массовое число элемента, Z – число протонов |
| Электрон, ē | 1/1837 | -1 | Число электронов равно порядковому номеру элемента в таблице Д.И. Менделеева |
Опорный лист 4
| Алгоритм | Пример |
| 1.Выберите элемент в ПСХЭ и запишите его знак. 2.Запишите атомный номер элемента Z и его массовое число А. 3.Определите состав атома: -число протонов -число электронов -число нейтронов. 4.Запишите состав атома. 5.Сделайте вывод. | 1. Бор – В. 2. Z=5, А=11. 3. N (р+)=5, N (ē)=5, N (n0)=11-5=6. 4. В (5р+, 6n0)5ē. Ядро атома бора состоит из пяти протонов и шести нейтронов, а электронная оболочка – из пяти электронов. |
Опорный лист 5
Периодическая система химических элементов Д.И. Менделеева
Опорный лист 6
Таблица 2. Разновидности атомов водорода
| Частица | Протий 1H | Дейтерий 2D | Тритий 3T |
| Z=1 |
| Протон | 1 | 1 | 1 |
| Электрон | 1 | 1 | 1 |
| Нейтрон | 0 | 1 | 2 |
Приложение 4. Рефлексивный лист
Ваше впечатления об уроке по теме «Атом – сложная частица. Строение атомного ядра» (обведите одну из четырех цифр)?
ФИО ________________________________________________________________________________
| 1. Было несложно, интересно. | 3. Было сложно, неинтересно. |
| 2. Было сложно, но интересно. | 4. Другое (напишите). |
Приложение 2´. Адаптированный рабочий лист
Тема урока ________________________________________________________
Дата урока _________________________________________________________
ФИО ______________________________________________________________
| Знаем | Хотим узнать | Узнали |
|
|
|
|
Задание 1. Докажите сложность строения атома, для этого вставьте пропущенные слова в тексте, используя опорные листы 2, 3:
1. Атом – это частица, состоящая из ________________________________
_______________________________________________________________.
2. В состав ядра атома входят ________________ и _________________.
3. Протон – элементарная частица, имеющая массу приблизительно ___ и заряд равный ___. Для протона принято обозначение ___.
4. Ядро атома имеет _________________ заряд.
5. Нейтрон – элементарная частица, имеющая массу приблизительно ___ и заряд равный ___. Для нейтрона принято обозначение ___.
6. Вокруг ядра постоянно движутся _____________, их заряд – ___, а масса – ___.
7. Масса атома сосредоточена в __________, т.к. массой __________ можно пренебречь.
8. Атом электронейтрален, т.к._____________________________________
_______________________________________________________________.
9. По разности _______________________________________ определяют число нейтронов в атоме.
Задание 2. Используя алгоритм (опорный лист 4) и Периодическую систему химических элементов Д.И. Менделеева (опорный лист 5), заполните таблицу (выбрать из предложенных заданий одно), а затем выполните самопроверку.
| № задания | Знак химического элемента | Название | Число протонов | Число нейтронов | Число электронов |
| 1 | S |
|
|
|
|
| 2 |
| Алюминий |
|
|
|
| 3 |
|
| 14 |
|
|
| 4 |
|
|
|
| 20 |
| Итого, общее количество баллов: |
Критерии оценки: без ошибок – молодец (5б.), 1–2 ошибки – не все потеряно (4-3б.), 3–4 ошибки – стоит обратить на это особое внимание (0б.).
Вывод:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Оценка за урок___________.
Приложение 3´. Адаптированные опорные листы
Опорный лист 1
Элементы встали вряд,
В ядрах их растет заряд.
Значит столько в нем протонов,
А в округе – электронов.
Есть в ядре еще нейтроны,
Что заряд иметь не склонны.
Ну а то, что в массе дробь,
В том виновен изотоп.
Опорный лист 2

Рисунок 1. Схема строения атома
Опорный лист 3
Таблица 1. Основные характеристики некоторых элементарных частиц
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон, р+ | 1 | +1 | Число протонов равно порядковому номеру элемента в таблице Д.И. Менделеева |
| Нейтрон, n0 | 1 | 0 | Число нейтронов находят по формуле N(n0) = А – Z, где А – массовое число элемента, Z – число протонов |
| Электрон, ē | 1/1837 | -1 | Число электронов равно порядковому номеру элемента в таблице Д.И. Менделеева |
Опорный лист 4
| Алгоритм | Пример |
| 1.Выберите элемент в ПСХЭ и запишите его знак. 2.Запишите атомный номер элемента Z и его массовое число А. 3.Определите состав атома: -число протонов -число электронов -число нейтронов. 4.Запишите состав атома. 5.Сделайте вывод. | 1. Бор – В. 2. Z=5, А=11.
3. N (р+)=5, N (ē)=5, N (n0)=11-5=6. 4. В (5р+, 6n0)5ē. Ядро атома бора состоит из пяти протонов и шести нейтронов, а электронная оболочка – из пяти электронов. |
Опорный лист 6
Таблица 2. Разновидности атомов водорода
| Частица | Протий 1H | Дейтерий 2D | Тритий 3T |
| Z=1 |
| Протон | 1 | 1 | 1 |
| Электрон | 1 | 1 | 1 |
| Нейтрон | 0 | 1 | 2 |
Опорный лист 5
Периодическая система химических элементов Д.И. Менделеева

Приложение 4´. Адаптированный рефлексивный лист
Ваше впечатления об уроке по теме «Атом – сложная частица. Строение атомного ядра» (обведите одну из четырех цифр)?
ФИО___________________________________________________________
| 1. Было несложно, интересно. | 3. Было сложно, неинтересно. |
| 2. Было сложно, но интересно. | 4. Другое (напишите). |




















