© 2021, Кривенко Алина Александровна 342 1


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Методические рекомендации для выполнения самостоятельных работ по Физической и коллоидной химии
Просмотр содержимого документа
«Методические рекомендации для выполнения самостоятельных работ по Физической и коллоидной химии»


СОДЕРЖАНИЕ
Рекомендации к выполнению самостоятельной работы………………………..6
Рекомендации по работе с видами самостоятельной работы студентов……..7
Работа с текстом учебника……………………………………………………….7
Работа с учебной справочной литературой……………………………………..8
Работа с сетью Интернет………………………………………………………….9
Составление конспекта………………………………………………………….10
Оформление доклада…………………………………………………………….12
Подготовка сообщений………………………………………………………….15
Оформление презентации……………………………………………………….15
Самостоятельная работа студентов при решении задач………………………19
Рекомендации по письменным ответам на вопросы…………………………..20
Рекомендации для подготовки к практическим занятиям…………………….21
Рекомендации для подготовки к защите практической работы……………..22
Рекомендации для студентов по подготовке к дифференцированному зачету……………………………………………………………………..………23
Критерии оценивания ответов на дифференцированном зачете…………….24
Задания для самостоятельной работы………………………………………….26
Тренировочный тест для дифференцированного зачета……………………...37
Список литературы………………………………………………………………44
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Пособие предназначено для обучающихся, осваивающих учебную дисциплину ОП.05 Физическая и коллоидная химия. В пособии представлены рекомендации по выполнению самостоятельной работы для обучающихся, осваивающих специальность 18.02.04 Электрохимическое производство. Целью самостоятельной работы обучающихся является систематизация и закрепление полученных теоретических знаний и практических умений студентов; углубление и расширение теоретических знаний; формирование умений использовать нормативную, правовую, справочную документацию и специальную литературу; развитие познавательных способностей и активности студентов: творческой инициативы, самостоятельности, ответственности и организованности; формирование самостоятельности мышления, способностей к саморазвитию, самосовершенствованию и самореализации; развитие исследовательских умений; использование материала, собранного и полученного в ходе самостоятельных занятий на практических занятиях, при написании курсовых и дипломных проектов, для эффективной подготовки к итоговым зачетам и экзаменам.
Самостоятельная работа студентов является важным видом учебной и научной деятельности студента. Самостоятельная работа студентов играет значительную роль в технологии обучения.
Целью методических рекомендаций является:
- подготовка к аудиторным занятиям и выполнение заданий;
- подготовка к практическим работам, их оформление;
-выполнение домашних заданий в виде решения отдельных задач, проведения типовых расчетов по отдельным разделам содержания дисциплины;
- написание сообщений;
- подготовка ко всем видам контрольных испытаний, в том числе и промежуточной аттестации по учебной дисциплине ОП.05 Физическая и коллоидная химия;
- участие в научных и научно-практических конференциях.
Выполнение любого вида самостоятельной работы предполагает прохождение обучающимися следующих этапов:
- определение цели самостоятельной работы;
- конкретизация познавательной (проблемной или практической) задачи;
- выбор адекватного способа действий, ведущего к решению задачи (выбор путей и средств для ее решения);
- планирование (самостоятельно или с помощью преподавателя) самостоятельной работы по решению задачи;
- реализация программы выполнения самостоятельной работы.
Самостоятельная работа обучающихся по специальности 18.02.04 Электрохимическое производство в соответствии с программой составляет 30 часов.
В ходе изучения учебного предмета ОП.05 Физическая и коллоидная химия предлагаются следующие формы и виды самостоятельной работы обучающихся:
1. Чтение основной и дополнительной литературы;
2. Поиск необходимой информации в сети Интернет;
3. Конспектирование источников;
4. Подготовка устного сообщения с презентацией для выступления на лекционном занятии;
5. Решение дополнительных задач по темам согласно рабочей программе;
6. Подготовка ответов на дополнительные вопросы для усвоения лекционного материала;
7. Подготовка защиты практической работы.
1. Рекомендации к выполнению самостоятельной работы
Перед выполнением обучающимися внеаудиторной самостоятельной работы преподаватель проводит инструктаж по выполнению задания, который включает цель задания, его содержание, ориентировочный объем работы, основные требования к результатам работы, критерии оценки. В процесса инструктажа преподаватель предупреждает студентов о возможных типичных ошибках, встречающихся при выполнении задания.
В помощь студенту представлены характеристики всех типов заданий, используемых в сборнике, алгоритм работы студента, критерии оценки.
Указания к выполнению внеаудиторной самостоятельной работы
Внеаудиторную самостоятельную работу нужно выполнять в рабочей тетради.
Необходимо оставлять поля шириной 5 клеточек для замечаний преподавателя.
Решения задач следует излагать подробно и аккуратно, объясняя и мотивируя все действия по ходу решения.
Оформление решения задачи следует завершать словом «Ответ».
После получения проверенной преподавателем работы студент должен в этой же тетради исправить все отмеченные ошибки и недочеты. Вносить исправления в сам текст работы после ее проверки запрещается.
Оценивание индивидуальных образовательных достижений по результатам выполнения внеаудиторной самостоятельной работы производится в соответствии с универсальной шкалой (таблица).
Таблица 1. Критерии оценивания
| Процент результативности (правильных ответов) | Качественная оценка индивидуальных образовательных достижений | |
| балл (отметка) | вербальный аналог | |
| 90 – 100 | 5 | отлично |
| 80 – 89 | 4 | хорошо |
| 70 – 79 | 3 | удовлетворительно |
| менее 70 | 2 | неудовлетворительно |
Алгоритм работы обучающегося
1. Прежде чем выполнить задание, четко сформулируйте цель предстоящей деятельности;
2. Подумайте и до конца осознайте, почему вы будите это делать, для чего это нужно;
3. Оцените и проанализируйте возможные пути достижения цели;
4. Выберите наилучший вариант взвесив все условия;
5. Наметьте промежуточные этапы предстоящей работы, определите время выполнения каждого этапа;
6. Во время реализации плана постоянно контролируйте себя и свою деятельность. Корректируйте работу, с учетом получаемых результатов, т.е. осуществляйте и используйте обратную связь с преподавателем;
7. По окончанию работы проанализируйте ее результаты, оцените степень их совпадения с поставленной целью.
2. Рекомендации по работе с видами самостоятельной работы студентов
2.1 Работа с текстом учебника
1. Прочитайте весь текст, составьте целостное представление об изложенных в нем событиях, явлениях. Внимательно рассмотрите схемы, таблицы и другие иллюстрации.
2. Обратите внимание на выделенные в тексте новые понятия. Формулировки законов, обобщения, выводы, основные факты.
3. Составьте развернутый план, это поможет в осмыслении научной информации.
4. Вспомните, что изучалось ранее по данной тематике. Иногда необходимо восстановить в памяти базовые положения, принципы, законы, понятия.
5. В случае необходимости обратитесь к глоссарию и справочной литературе. Выпишите новые понятия, термины, произнесите их вслух.
6. Проверьте, как усвоен новый материал, перескажите его, пользуясь планом, затем без него.
7. Подготовьте ответы на вопросы и задания, которые помещены в конце параграфа, главы.
8. Выполните задания, предложенные преподавателем.
Методические рекомендации по составлению плана
1. Внимательно прочитайте текст.
2. Разделите текст на логически законченные части.
3. Выделите в каждой из них главную мысль.
4. Озаглавьте части.
5. В каждой части выделите несколько положений, развивающих главную мысль.
6. Перескажите текст по вашему плану.
2.2. Работа с учебной справочной литературой
К справочным изданиям относятся: словари, справочники, справочные пособия, энциклопедии и энциклопедические словари, путеводители, календари и буклеты. Но все отмеченное разнообразие легко сводится к трем основным типам: словарь, справочник, энциклопедия.
Умение работать со справочной литературой обладает высокой профессиональной значимостью.
1. Прежде чем использовать справочную литературу, уточните, что вас интересует.
2. Подумайте, где вы сможете найти ответ на интересующий вас вопрос: в учебнике, справочнике, дополнительной литературе.
3. Прежде всего, используйте учебник, затем справочник и только после этого дополнительную литературу.
4. Если вы впервые пользуетесь справочной литературой, то сначала ознакомьтесь с оглавлением, предметным и именным указателями справочника.
5. Определите, в каком разделе могут находиться интересующие вас сведения. Определите по оглавлению нахождение данного раздела в справочнике.
6. Данные, полученные из справочной литературы, зафиксируйте в рабочей тетради.
2.3. Работа с сетью Интернет
Какие поисковые системы использовать и как оформить информацию?
1. Почти все содержимое Интернета хранится на сайтах. Терабайты текстов, картинок, схем, таблиц и видео разбросаны по сети. И среди всего этого обилия информации нужно как то ориентироваться. У Интернета нет содержания, как у книг, но зато, есть «Поисковая система».
2. Поисковых систем много и большинство из них специализируются на поиске определенной информации: рефератов, докладов, фильмов, видео, картинок и т.д. Например, Google – самая большая Всемирная поисковая система. Она выдает качественные результаты и предлагает ряд очень полезных сервисов. Yandex – поисковая система популярная на территории бывшего СНГ и ориентирована на русскоязычный сегмент Интернета. Достойный конкурент для Google, хоть и немного уступает по качеству поиска.
3. Какой поисковой системой пользоваться – это уже дело каждого. Но лучше использовать две одновременно.
Как найти нужную информацию в Интернете и как её оформить ?
1. Изначально, куда можно обратить за информацией это Википедия, хотя порой там и пишут полную чуть, но зато простым и понятным языком. Для первичного понимания информации – вполне неплохо.
2. Дальше – книги, словари, научные статьи.
3. Вводите в поисковик четкое задание, например: «Вязкость – это…».
4. Как показывает практика, лучшие ответы на вопрос высвечиваются на первой странице.
5. На нужный текст нажимаете левой кнопкой мыши, выделяете, правой кнопкой нажимаете и находите команду «Копировать», после чего переходите на страницу документа Word и левой кнопкой мыши выбираете команду «Вставить».
6. Иллюстрации вначале сохраняете командой «Сохранить картинку как», затем вставляете ее либо в Word, либо же если это необходимо то в Power Point.
7. Внимательно читайте скопированный текст, удаляя авторские сноски.
8. Из скопированного текста выделяйте самое главное, основную идею текста.
9. Все найденные необходимые вам файлы нужно сохранить в папке с четким названием.
10. Внутри папки создать разделы, которые также будут иметь название. Это организует. Лишней информации не бывает, всегда может пригодиться.
2.4. Составление конспекта
Конспект – краткое письменное изложение содержания книги, научной или публицистической статьи, статьи учебного пособия. Умение составлять конспект является общеучебным умением, которое помогает более эффективно осваивать материал по любой учебной дисциплине и т.д.
Правила конспектирования:
Записать название конспектируемого материала.
Осмыслить основное содержание текста, дважды прочитав его.
Составить план - основу конспекта.
Конспектируя, оставить место (широкие поля) для дополнений, заметок, записи незнакомых терминов и имен, требующих разъяснений.
Помнить, что в конспекте отдельные фразы и даже отдельные слова имеют более важное значение, чем в подробном изложении.
Запись вести своими словами, это способствует лучшему осмыслению текста.
Применять определенную систему подчеркивания, сокращений, условных обозначений.
Соблюдать правила цитирования - цитату заключать в кавычки, давать ссылку на источник с указанием страницы.
Научитесь пользоваться цветом для выделения тех или иных информативных узлов в тексте. У каждого цвета должно быть строго однозначное, заранее предусмотренное назначение.
Учитесь классифицировать знания, т.е. распределять их по группам, параграфам, главам и т.д. Для распределения можно пользоваться буквенными обозначениями, русскими или латинскими, а также цифрами, а можно их совмещать.
План оформления конспекта:
1.Внимательно прочитайте текст. Уточните в справочной литературе непонятные слова. При записи не забудьте вынести справочные данные на поля конспекта.
2.Выделите главное, составьте план.
3. Сформулируйте основные положения текста, отметьте аргументацию автора.
4.Законспектируйте материал, четко следуя пунктам плана. При конспектировании старайтесь выразить мысль своими словами. Записи следует вести четко, ясно.
5.Грамотно записывайте законы и определения. Учитывайте лаконичность, значимость мысли.
В тексте конспекта желательно приводить не только формулировки законов, но и их доказательства. При оформлении конспекта необходимо стремиться к емкости каждого предложения. Мысли следует излагать кратко. Число дополнительных элементов конспекта должно быть логически обоснованным, записи должны распределяться в определенной последовательности, отвечающей логической структуре. Для уточнения и дополнения необходимо оставлять поля. Овладение навыками конспектирования требует от студента целеустремленности, повседневной самостоятельной работы.
Критерии оценки конспекта:
- содержательность конспекта, соответствие плану;
- отражение основных положений, результатов работы автора, выводов;
- ясность, лаконичность изложения мыслей студента;
- наличие схем, графическое выделение особо значимой информации;
- соответствие оформления требованиям;
- грамотность изложения.
2.5. Оформление доклада
Доклад – это устное выступление на заданную тему. В учебных учреждениях время доклада, как правило, составляет 5-15 минут.
Цели доклада:
1. Научиться убедительно и кратко излагать свои мысли в устной форме. (Эффективно продавать свой интеллектуальный продукт).
2. Донести информацию до слушателя, установить контакт с аудиторией и получить обратную связь.
План и содержание доклада
Важно при подготовке доклада учитывать три его фазы: мотивацию, убеждение, побуждение. В первой фазе доклада рекомендуется использовать:
- риторические вопросы;
- актуальные местные события;
- личные происшествия;
- истории, вызывающие шок;
- цитаты, пословицы;
- возбуждение воображения;
- оптический или акустический эффект;
- неожиданное для слушателей начало доклада.
Как правило, используется один из перечисленных приёмов. Главная цель фазы открытия (мотивации) – привлечь внимание слушателей к докладчик поэтому длительность её минимальна.
Ядром хорошего доклада является информация. Она должна быть новой понятной. Важно в процессе доклада не только сообщить информацию, но убедить слушателей в правильности своей точки зрения.
Третья фаза доклада должна способствовать положительной реакции слушателей. В заключении могут быть использованы:
- обобщение;
- прогноз;
- цитата;
- пожелания;
- объявление о продолжении дискуссии;
- просьба о предложениях по улучшению;
благодарность за внимание.
Объем доклада должен быть от 4 до 8 страниц вместе со всеми формулами, рисунками, списком литературы и при соблюдении условий, оговоренных ниже. Рекомендуется набирать текст с использованием текстового процессора Microsoft Word for Windows (формат .doc или .rtf), соблюдая следующие правила:
-поля: слева – 20 мм; снизу и сверху – 20 мм; справа – 10 мм;
-шрифт Times New Roman, кегль 12;
-первым элементом текста должно быть название доклада, набранное прописными буквами жирным шрифтом и выровненное по центру. Далее следует оставить одну пустую строку и указать автора/авторов доклада и на следующей строке/строках – названия представляемых авторами организаций, набранные курсивом, почтовый индекс и город. Два последних элемента также следует выровнять по центру;
- основной текст должен быть отделен от названия организации одной пустой строкой и набран в одну колонку через единичный интервал;
- абзацы основного текста должны быть выровнены по ширине и иметь абзацный отступ величиной 1,27 см;
- следует избегать использования в тексте сносок и ссылок, оглавлений и указателей, концов страниц и разделов (то есть всего того, что можно обнаружить в меню Вставка MS Word), а также идущих подряд пробелов для форматирования текста;
- рисунки нужно вставить в документ, расположив их между абзацами (не поверх текста). Черно-белые рисунки искусственного происхождения (графики, диаграммы, схемы), в том числе снятые сканером, желательно сделать двухградационными (1 бит/пиксел);
- ссылки на литературу обозначаются цифрами в квадратных скобках [1], [2], ...
- список литературы должен быть озаглавлен «Список источников».
Текст необходимо тщательно проверить.
Критерии оценки доклада:
- актуальность темы исследования;
- соответствие содержания теме;
- глубина проработки материала;
-правильность и полнота использования источников;
- соответствие оформления доклада стандартам.
По усмотрению преподавателя доклады могут быть представлены на семинарах, научно-практических конференциях, а также использоваться как зачетные работы по пройденным темам.
2.6. Подготовка сообщений
Подготовка сообщения - это вид внеаудиторной самостоятельной работы по подготовке небольшого по объему устного сообщения для озвучивания на аудиторном занятии. Сообщаемая информация носит характер уточнения или обобщения, несет новизну, отражает современный взгляд по определенным проблемам.
Сообщение отличается от докладов и рефератов не только объемом информации, но и ее характером - сообщения дополняют изучаемый вопрос фактическими или статистическими материалами. Оформляется задание письменно, оно может включать элементы наглядности (иллюстрации, демонстрацию, презентацию)
Регламент времени на озвучивание сообщения - до 5 мин. Для выполнения самостоятельной работы необходимо:
- собрать и изучить источники информации по теме;
- составить план сообщения;
- выделить основные понятия;
- ввести в текст дополнительные данные, характеризующие объект изучения;
- оформить текст письменно;
- сдать на контроль преподавателю и озвучить в установленный срок.
Критерии оценки сообщения:
1. Актуальность темы.
2. Соответствие содержания теме; глубина проработки материала.
3. Грамотность и полнота использования источников; наличие элементов наглядности.
2.7. Оформление презентации
Требования к презентации
На первом слайде размещается:
- название презентации;
- автор: ФИО, группа, название учебного учреждения (соавторы указываются в алфавитном порядке);
- год.
На втором слайде указывается содержание работы, которое лучше оформить в виде гиперссылок (для интерактивности презентации).
На последнем слайде указывается список используемой литературы в соответствии с требованиями, интернет-ресурсы указываются в последнюю очередь.
- необходимо соблюдать единый стиль оформления;
- нужно избегать стилей, которые будут отвлекать от самой презентации;
- вспомогательная информация (управляющие кнопки) не должны преобладать над основной информацией (текст, рисунки)
Фон
- для фона выбираются более холодные тона (синий или зеленый)
Использование цвета
- на одном слайде рекомендуется использовать не более трех цветов: один для фона, один для заголовков, один для текста;
- для фона и текста используются контрастные цвета;
- особое внимание следует обратить на цвет гиперссылок (до и после использования)
Анимационные эффекты
- нужно использовать возможности компьютерной анимации для представления информации на слайде;
- не стоит злоупотреблять различными анимационными эффектами;
- анимационные эффекты не должны отвлекать внимание от содержания информации на слайде
Звук
- звуковое сопровождение должно отражать суть или подчеркивать особенность темы слайда, презентации;
- необходимо выбрать оптимальную громкость, чтобы звук был слышен всем слушателям, но не был оглушительным;
- если это фоновая музыка, то она должна не отвлекать внимание слушателей и не заглушать слова докладчика. Чтобы все материалы слайда воспринимались целостно, и не возникало диссонанса между отдельными его фрагментами, необходимо учитывать общие правила оформления презентации.
Представление информации
Содержание информации:
- следует использовать короткие слова и предложения;
- времена глаголов должно быть везде одинаковым;
- следует использовать минимум предлогов, наречий, прилагательных;
- заголовки должны привлекать внимание аудитории
Расположение информации на странице:
- предпочтительно горизонтальное расположение информации;
- наиболее важная информация должна располагаться в центре экрана;
- если на слайде располагается картинка, надпись должна располагаться под ней
Шрифты
- для заголовков не менее 24;
- для остальной информации не менее 18;
- шрифты без засечек легче читать с большого расстояния;
- нельзя смешивать разные типы шрифтов в одной презентации;
- для выделения информации следует использовать жирный шрифт, курсив или подчеркивание того же типа;
- нельзя злоупотреблять прописными буквами (они читаются хуже, чем строчные).
Способы выделения информации
Следует использовать:
- рамки, границы, заливку
- разные цвета шрифтов, штриховку, стрелки
- рисунки, диаграммы, схемы для иллюстрации наиболее важных фактов
Объем информации
- не стоит заполнять один слайд слишком большим объемом информации: люди могут единовременно запомнить не более трех фактов, выводов, определений.
- наибольшая эффективность достигается тогда, когда ключевые пункты отражаются по одному на каждом отдельном слайде.
Виды слайдов
Для обеспечения разнообразия следует использовать разные виды слайдов:
- с текстом;
- с таблицами;
с диаграммами.
Критерии оценки презентации
Содержание оценки
1. Содержательный критерий
правильный выбор темы, знание предмета и свободное владение текстом, грамотное использование научной терминологии, импровизация, речевой этикет
2. Логический критерий
стройное логико-композиционное построение речи, доказательность, аргументированность
3. Речевой критерий
использование языковых (метафоры, фразеологизмы, пословицы, поговорки и т.д.) и неязыковых (поза, манеры и пр.) средств выразительности; фонетическая организация речи, правильность ударения, четкая дикция, логические ударения и пр.
4. Психологический критерий
взаимодействие с аудиторией (прямая и обратная связь), знание и учет законов восприятия речи, использование различных приемов привлечения и активизации внимания
5. Критерий соблюдения дизайн-эргономических требований к компьютерной презентации
соблюдены требования к первому и последним слайдам, прослеживается обоснованная последовательность слайдов и информации на слайдах, необходимое и достаточное количество фото- и видеоматериалов, учет особенностей восприятия графической (иллюстративной) информации, корректное сочетание фона и графики, дизайн презентации не противоречит ее содержанию, грамотное соотнесение устного выступления и компьютерного сопровождения, общее впечатление от мультимедийной презентации
2.8. Самостоятельная работа студентов при решении задач
В процессе изучения дисциплины наряду с некоторыми теоретическими сведениями студенты овладевают и закрепляют способы решения задач. Обычно с такими способами знакомит сам преподаватель, показывая решение задач по темам. Наиболее эффективным при этом является такой подход, при котором преподаватель раскрывает перед студентами технологию решения задачи, показывает, чем мотивировано применение некоторого метода решения, чем обусловлен выбор того или иного пути.
Работа над задачей тоже может быть полностью самостоятельной работой студентов. Она преследует несколько целей:
- продолжить формирование умений самостоятельно изучать текст, который в данном случае представляет собой задачу;
- обучить рассуждениям;
- обучить оформлению решения задач. К тому же студенты будут знать, что у них имеется образец рассуждений и оформления задачи, к которому они могут обратиться при решении другой задачи или при проверке правильности своего решения.
Большие возможности для подготовки студентов к творческому труду и самостоятельному пополнению знаний имеет самостоятельное выполнение заданий. В этом случае студент без какой-либо помощи должен наметить пути решения, правильно выполнить все построения, преобразования, вычисления и т. п. В таком случае мысль студента работает наиболее интенсивно. Он приобретает практический навык работы в ситуации, с которой ему неоднократно придется сталкиваться в последующей трудовой деятельности. Вообще при самостоятельном выполнении заданий мыслительные процессы не могут быть проконтролированы преподавателем. Поэтому даже верный ответ может оказаться случайным. Исправление ошибок, допущенных при самостоятельной работе, происходит в ходе ее проверки по окончании всей работы. Поэтому, выполняя упражнение самостоятельно, студент, не усвоивший материал, может повторять одну и ту же ошибку от примера к примеру и невольно закрепить неправильный алгоритм.
Критерии оценивания умений обучающихся решать расчетные задачи:
Оценка «5» – в логическом рассуждении и решении нет ошибок, задача решена рациональным способом.
Оценка «4» – в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Оценка «3» – в логическом рассуждении и решении нет существенных ошибок, но допускается существенная ошибка в математических расчетах.
Оценка «2» – имеются существенные ошибки в логическом рассуждении и в решении.
2.9 Рекомендации по письменным ответам на вопросы
Письменные ответы на вопросы - это контрольное опрашивание, проверка степени и осознанности усвоения учебного материала всей группы.
Такой способ опроса позволяет охватить проверкой многих студентов; вырабатывает способность к краткому, но точному ответу; обращает внимание на существенные детали темы и способствует их запоминанию; приучает к последовательности и обоснованности изложения материала; вовлекает в работу всю группу, активизируя процессы внимания и мышления.
Опрос способствует развитию умственных способностей студентов, воспитанию моральных и волевых качеств, связанных с преодолением трудностей учения. Он влияет на общее развитие студентов, на формирование качеств личности, на отношение студентов к учебе.
Критерии оценки ответов на вопросы:
- наличие обобщающего (систематизирующего, структурирующего, сравнительного) характера изложения информации;
- грамотность и полнота использования источников;
- умение вести дискуссию и ответы на вопросы.
2.10. Рекомендации для подготовки к практическим занятиям
Для того чтобы практические занятия приносили максимальную пользу, необходимо помнить, что упражнение и решение ситуативных задач проводятся по вычитанному на лекциях материалу и связаны, как правило, с детальным разбором отдельных вопросов лекционного курса. Следует подчеркнуть, что только после усвоения лекционного материала с определенной точки зрения (а именно с той, с которой он излагается на лекциях) он будет закрепляться на практических занятиях как в результате обсуждения и анализа лекционного материала, так и с помощью решения ситуативных задач. При этих условиях студент не только хорошо усвоит материал, но и научится применять его на практике, а также получит дополнительный стимул (и это очень важно) для активной проработки лекции.
При самостоятельном решении поставленных задач нужно обосновывать каждый этап действий, исходя из теоретических положений курса. Если обучающийся видит несколько путей решения проблемы (задачи), то нужно сравнить их и выбрать самый рациональный. Полезно до начала решения поставленных задач составить краткий план решения проблемы (задачи). Решение проблемных задач или примеров следует излагать подробно, нужно сопровождать комментариями, схемами, чертежами и рисунками, инструкциями по выполнению.
Следует помнить, что решение каждой учебной задачи должно доводиться до окончательного логического ответа, которого требует условие, и по возможности с выводом. Полученный результат следует проверить способами, вытекающими из существа данной задачи.
2.11. Рекомендации для подготовки к защите практической работы.
На практической работе по физической и коллоидной химии студент знакомится с важнейшими методами физико-химических исследований и получает навыки самостоятельной экспериментальной работы. При выполнении работы студент должен научиться пользоваться современной аппаратурой и приборами, освоить методы обработки результатов измерений, используя графические и аналитические методы, научиться оформлять результаты работы в виде таблиц и графических материалов.
Практические занятия требуют строжайшей дисциплины, тщательного соблюдения и техники безопасности и правил работы в лаборатории.
Перед работой студент изучает теоретический материал, необходимый для выполнения практической работы. К практической работе допускаются студенты, сдавшие технику безопасности и ход работы.
После выполнения работы студент самостоятельно оформляет отчет.
В бланк отчета заносят:
- наблюдения в таблицы для записи;
- расчетные формулы;
- таблицу измерений с указанием единиц измерения;
- обработку экспериментальных данных и расчет измеряемой величины,
вычисление погрешности;
- график на миллиметровой бумаге (если он предусмотрен по содержанию работы).
Отчет считается принятым, если он содержит удовлетворительные данные измерений и оформлен в соответствии с перечисленными требованиями, и устно студент ответил на контрольные вопросы.
2.12 Рекомендации для студентов по подготовке к дифференцированному зачету
Существует нескольких факторов, влияющих на успешность сдачи зачета. Основные из них:
– целенаправленность и системность учебной деятельности всех студентов в течение семестра.
– выбор правильной методики подготовки студентами.
Рекомендации для студентов по подготовке к дифференцированному зачету:
1. Придерживайтесь правила: «Делу - время, потехе - час». Перед началом подготовки очень важно просмотреть весь материал и отложить тот, с которым вы хорошо знакомы. Начинать учить необходимо с незнакомого или нового материала.
2. Используйте время эффективно. Новый материал изучайте в то время суток, когда хорошо думается, то есть высока работоспособность, как правило, до обеда.
3. Подготовьте место для занятий, убрав со стола лишние вещи, удобно расположив учебники и дополнительную литературу, тетради, по необходимости – канцелярские принадлежности.
4. Начинайте готовиться к зачету заранее, по частям, сохраняя спокойствие. Для облегчения своего труда составьте план на каждый день подготовки, где определите, что именно сегодня будет изучаться и время занятий с учетом вашего режима дня.
5. К трудно запоминаемому материалу возвращайтесь несколько раз, просматривайте его вечером, а затем еще раз - утром.
6. Очень полезно составлять планы конкретных тем и держать их в уме, а не зазубривать всю тему. Можно воспользоваться методом написания вопросов в виде краткого, тезисного изложения материала.
7. Заучиваемый материал лучше разбить на части, стараясь, чтобы их количество не превышало семи, а затем укрупнять и обобщать их, выражая главную мысль одной фразой. Текст можно сильно сократить, представив его в виде схемы.
8. Пересказывайте текст своими словами, что приводит к лучшему его запоминанию, чем многократное чтение. Вообще, любая аналитическая работа с текстом приводит к его лучшему запоминанию.
9. Всегда, а во время подготовки к зачетам особенно, заботьтесь о своем здоровье. В это время нужно хорошо и вовремя питаться. Не забывайте о прогулках и спортивных развлечениях, делайте перерывы. Хорошо отдыхайте - сон необходим. Ни в коем случае не засиживайся допоздна перед зачётом!
10. Ежедневно выполняйте упражнения, которые способствуют снятию внутреннего напряжения и усталости.
2.13. Критерии оценивания ответов на дифференцированном зачете
Для перевода из бальной системы в оценки применяется следующая система:
0-33 баллов – оценка – «2»
38-34 баллов – оценка – «3»
44-39 баллов – оценка – «4»
50-45 баллов – оценка – «5»
При оценивании ответа на вопрос и решение задачи учитывается:
- полнота, обоснованность, четкость изложения ответа;
- умение студентами в полном объеме использовать теоретические знания при подготовке к ответу.
Таким образом, освоение учебной дисциплины студентами оценивается на:
«5» («отлично») - за глубокое и полное овладение содержанием учебного материала, в котором обучающийся легко ориентируется, владеет основными понятиями, грамотно и логично излагает ответ;
«4» («хорошо») - если студент полно освоил учебный материал, владеет основными понятиями, ориентируется в изученном материале, грамотно излагает ответ, но содержание и форма ответа имеют отдельные неточности или формальные ошибки;
«3» («удовлетворительно») - если обучающийся обнаруживает знание и понимание основных положений учебного материала, но указывает частично неполные или неправильные ответы, допускает неточности в определении понятий, не умеет доказательно построить развёрнутый ответ или суждения;
«2» («неудовлетворительно») - если обучающийся имеет разрозненные, бессистемные знания, не умеет выделять главное и второстепенное, допускает ошибки в определении понятий, законов, искажает их смысл, беспорядочно и неуверенно излагает материал при развёрнутом ответе.
3. Задания для самостоятельной работы
Самостоятельная работа №1
Практическая работа № 1,2
«Расчет параметров газов и газовых смесей с применением основных газовых законов»
«Построение графиков изопроцессов с применением основных газовых законов»
Цель: Формирование у студентов умений и навыков решения задач разных типов, произвести расчеты полученных результатов ,подготовится к защите работы.
Методические рекомендации
Закон Бойля – Мариотта
При постоянной температуре произведение объёма газа на его давление – величина постоянная
![]() (1)
(1)
Зависимость давления газа от объема при постоянной температуре графически и зображают кривой, которую называют изотермой.
зображают кривой, которую называют изотермой.
Закон Гей – Люссака
При постоянном давлении объёмы данного количества газа прямо пропорциональны абсолютным температурам
 (2)
(2)
Графическая зависимость объема от температуры изображается прямой линией – изобарой. При очень низких температурах закон Гей-Люссака не в ыполняется, поэтому сплошная линия на графике заменена пунктиром.
ыполняется, поэтому сплошная линия на графике заменена пунктиром.
Закон Шарля
При постоянном объёме давления данного количества газа прямо пропорциональны абсолютным температурам
 (3)
(3)
Объединенное уравнение закона идеального газа имеет вид
![]() или
или  (4)
(4)
Графическая зависимость давления от температуры изображается прямой
линией – изохорой.

Уравнение Менделеева – Клапейрона
PV=Mr/m*RT (5)
где – m - масса данного газа, г; Mr - молекулярная масса газа, г/моль; R- газовая постоянная (в системе СИ =8,314 ); T – температура (273 К); Р – давление, Па; V – объем, моль/л.
Закон Авогадро
в равных объемах различных газов при одинаковых условиях содержится равное число молекул.
Число молекул (NА) в одном моле вещества одинаково у всех веществ и равно 6,02*10 м. Следовательно, моли веществ, находящихся в газообразном состоянии при одинаковой температуре и одинаковом давлении, занимают равные объемы. При нормальных условиях (температура 0 °С и давление 1 атм = 760 мм рт.ст. = 1,01325 • 105 н/м2 ) объем одного моля газа равен 22,414 л2.
Закон Дальтона: общее давление смеси газов равно сумме парциальных давлений составных частей (компонентов).
𝑃 = 𝜌1 + 𝜌2+. . . +𝜌𝑟 (6)
где Р – общее давление смеси газов;
p1, p2, pr – парциальные давления компонентов смеси.
Решение типовых задач
1. 100 мл газа, измеренных при нормальных условиях, приведите к стандартным условиям.
2. Даны 600 м3 газа при 70С и 100 кПа. Вычислите объѐм газа при -130°С и 80 кПа.
3. Вычислите массу 70мл кислорода, собранного над водой при 70°С и 102,3 кПа. Давление пара воды при той же температуре равно 1 кПа.
4. Вычертите представленную диаграмму в координатах рТ, рV

1-2: …………………………………………………………………………
2-3: ……………………………………………………...............................
3-4: …………………………………………………………………………
4-1: …………………………………………………………………………

5. 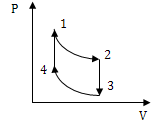 Вычертите представленную диаграмму в координатах рТ, VТ
Вычертите представленную диаграмму в координатах рТ, VТ
.
1-2: …………………………………………………………………………
2-3: ……………………………………………………................................
3-4: …………………………………………………………………………
4-1: …………………………………………………………………………

Самостоятельная работа №2
Практическая работа № 3, 4
«Определение вязкости жидкости вискозиметрическим методом. Влияние температуры и концентрации раствора на вязкость»
«Определение поверхностного натяжения жидкости»
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов ,подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
После выполнения работы произвести обработку полученных результатов, оформить таблицу, написать вывод по результатам.
Подготовить контрольные вопросы для зачета по практической работе.
Контрольные вопросы:
Что называется поверхностным натяжением?
Как измеряется поверхностное натяжение сталагмометром?
Какие факторы влияют на величину поверхностного натяжения.
Связь между поверхностным натяжением и смачиванием поверхностей.
Гидрофильность и гидрофобность поверхностей.
Как определить поверхностного натяжения?
Что называется вязкостью?
Факторы влияющие на вязкость.
Способы измерения вязкости.
Формулы используемые для математических расчетов вязкости.
Принцип работы с вискозиметром Оствальда.
Принцип работы с прибором Стокса.
Что называется относительной плотностью растворов?
Принцип практического измерения плотности с помощью пикнометра, расчетная формула.
Единицы измерения величин входящих в расчетные формулы.
Самостоятельная работа №3
Практическая работа № 6
«Определение теплового эффекта химических реакций»
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов ,подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
После выполнения работы произвести обработку полученных результатов, оформить таблицу, написать вывод по результатам.
Подготовить контрольные вопросы и решить типовые задачи для зачета по практической работе.
Контрольные вопросы:
Что называется тепловым эффектом химической реакции?
Закон Гесса, пример.
Напишите формулы для расчета тепловых эффектов химических реакций: а) по теплотам образования исходных веществ и продуктам реакции; б) по теплотам сгорания исходных веществ и продуктов реакции.
4. Что такое энтальпия и ее физический смысл?
5. Что такое энтропия и ее физический смысл?
Решение типовых задач:
1. Пользуясь данными таблиц справочными, для реакции

вычислите тепловой эффект, стандартное химическое сродство и константу равновесия реакции при стандартных условиях и температуре 800 К. По полученным результатам расчетов определите термохимические особенности реакции, направление протекания процесса, в стандартных и заданных условиях. Укажите, как следует изменить температуру и давление, чтобы увеличить выход продуктов реакции.
2. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. Определите в каком направлении при 298 °К (прямом или обратном) будет протекать реакция. Рассчитайте температуру, при которой равновероятны оба направления реакции.
Fe2O3 (к) + 3H2 = 2Fe(к) + 3H2O(г)
3. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений.
Самостоятельная работа №4
Практическая работа № 7
«Определение теплоты сгорания органического вещества»
«Определение теплоты растворения соли»
«Определение теплоты нейтрализации»
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов ,подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
После выполнения работы произвести обработку полученных результатов, оформить таблицу, написать вывод по результатам.
Подготовить контрольные вопросы и решить типовые задачи для зачета по практической работе.
Контрольные вопросы:
1. Сформулируйте и запишите I закон термодинамики.
2. Определите понятие “тепловой эффект химической реакции”.
3.Закон Гесса и следствия из него.
4. В каких случаях теплота реакции может являться функцией состояния.
5. Какие вещества можно отнести к топливу?
6.Чем характеризуется топливо?
7. Дать определение удельной теплоты сгорания. Назвать единицу измерения
Решение типовых задач:
1. Определить низшую теплоту сгорания 1 кг уксусной кислоты, если теплота ее образования 485,6 кДж/моль.
2. Рассчитать низшую теплоту сгорания QН органической массы состава: С – 62%, H − 8%, O – 28%, S – 2%.
3. Определить низшую теплоту сгорания QН 1 м3 газовой смеси, состоящей из СН4 – 60%, O2 – 5%, H2S – 25%, CO2 – 10%.
Самостоятельная работа №5
Практическая работа № 8
«Определение теплоты растворения соли»
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов ,подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
После выполнения работы произвести обработку полученных результатов, оформить таблицу, написать вывод по результатам.
Подготовить контрольные вопросы для зачета по практическим работам.
Контрольные вопросы:
1. Дать определение понятий: «термодинамическая система», «открытая система», «закрытая система», «изолированная система». Привести примеры.
2. Дать определение понятия «процесс» ? Дать определение изотермических, адиабатических, изобарических, изохорических процессов, обратимых и необратимых, равновесных и неравновесных процессов.
3. Теплоемкость, определение, виды, теплоемкость газов, жидкостей,
твердых веществ, зависимость теплоемкости от температуры.
4. Теплота образования, стандартная теплота образования. Расчет теплового эффекта по теплотам образования. Пример.
5. Теплота сгорания, стандартная теплота сгорания. Расчет теплового
эффекта по теплотам сгорания. Пример.
6. Теплота растворения. Почему процессы растворения веществ могут протекать не только с экзотермическим, но и с эндотермическим эффектом.
Самостоятельная работа №6
Практическая работа № 9
«Определение теплоты нейтрализации»
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов ,подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
После выполнения работы произвести обработку полученных результатов, оформить таблицу, написать вывод по результатам.
Подготовить контрольные вопросы для зачета по практической работе.
Контрольные вопросы:
1. Дайте определение таким понятиям как: термодинамика, химическая термодинамика, термохимия.
2. Сформулируйте Первое начало термодинамики.
3. Внутренняя энергия как функция состояния системы.
4. Напишите тепловые эффекты реакций образования, сгорания, нейтрализации, гидратообразования, растворения.
5. Сформулируйте закон Гесса и следствия из него.
6. Зависимость теплового эффекта реакции от температуры.
7. Что такое калориметрия, постоянная калориметра?
Самостоятельная работа №7
«Подготовка к контрольной работе»
Цель: закрепит полученные знания, путем решения задач по данной теме.
Письменно ответьте на вопросы:
1. Какие процессы называются термодинамически обратимыми, необратимыми?
2. Что такое самопроизвольно протекающие необратимые процессы? Каково направление и их предел протекания?
3. В чем заключается смысл и значение второго закона термодинамики?
4. Приведите формулировки второго закона термодинамики.
5. По какому принципу работает тепловая машина и как можно определить ее к.п.д.?
6. Что называется свободной и связанной энергией системы?
7. Что называется изохорным и изобарным термодинамическими потенциалами?
8. Что такое энтропия? Что характеризует изменение энтропии?
9. Сформулируйте принцип минимума свободной энергии.
10. Запишите выражения для расчета энергии Гиббса и Гельмгольца.
Литература:
Гамеева О.С.,Физическая и коллоидная химия.- М.:Высшая школа, 1977. – 328с.
Решение типовых задач:
1. В 0,30 кг жидкого ацетона поместили серебряную ложку массой 53 г. Определить энтропию системы при 25°С.
2. Выясните возможность получения металлического кадмия из сульфата кадмия (II) восстановлением оксидом углерода (II) по реакции:
2CdS(кр) + 2CO(г.)→CO2(г.)+CS2(г.) +2α-Cd.
3. Рассчитать стандартные энергии Гиббса и Гельмгольца реакции, используя значения стандартных энергий Гиббса, по реакции:
![]() .
.
Самостоятельная работа №8
Практическая работа №12
«Расчет термодинамических свойств влажного пара. I-d диаграмма влажного воздуха».
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов, на миллиметровой бумаге построить необходимые графики, подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
После выполнения работы произвести обработку полученных результатов, построить график, оформить таблицу, написать вывод по результатам.
Подготовить контрольные вопросы для зачета по практической работе.
Контрольные вопросы:
1. Какой пар входит в состав ненасыщенного влажного воздуха (влажный, сухой насыщенный, перегретый)?
2. Что называется абсолютной и относительной влажностью?
3. Как изменяется влагосодержание: а) при нагреве влажного воздуха? б) при охлаждении?
4. Какая температура влажного воздуха выше – мокрого термометра или росы?
5. Дайте определение парциального давления водяного пара во влажном воздухе.
6. Дайте определение и расчетное выражение абсолютной влажности воздуха, поясните, какие допущения делаются для влажного атмосферного воздуха и какую формулу при этом используют для расчета его абсолютной влажности.
7. Дайте определение и расчетное выражения относительной влажности воздуха, поясните, какую формулу используют для расчета относительной влажности атмосферного воздуха.
8. Назовите основные состояния влажного воздуха и соответствующие этим состояниям параметры и характеристики влажного воздуха.
9. Дайте определение температуры точки росы влажного воздуха и покажите эту изотерму в диаграмме для водяного пара.
10. Дайте определение влагосодержания воздуха и приведите расчетное выражение влагосодержания пара для атмосферного влажного воздуха.
Самостоятельная работа №9
Практическая работа № 13-14
«Изучение явления адсорбции».
«Построение изотермы адсорбции уксусной кислоты статистическим методом».
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов, на миллиметровой бумаге построить необходимые графики, подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
После выполнения работы произвести обработку полученных результатов, построить график, оформить таблицу, написать вывод по результатам.
Подготовить контрольные вопросы для зачета по практической работе.
Контрольные вопросы:
1. Что такое адсорбция? Какие причины обуславливают адсорбционную способность вещества?
2.Приведите примеры адсорбционных процессов в промышленности и быту.
3. Что такое адсорбент, адсорбат?
4. В чем суть процесса адсорбции? Чем понятие «абсорбция» отличается от понятия «адсорбция»? 4. Что такое адсорбция и десорбция?
5. Чем отличается процесс физической адсорбции от химической адсорбции?
6. Какие факторы влияют на адсорбцию?
7. Почему адсорбция - процесс самопроизвольный?
8. Как экспериментально определить тип адсорбции?
Самостоятельная работа №10
Практическая работа № 15
«Определение сдвига химического равновесия по принципу Ле-Шателье».
Цель: Знать правила выполнения практической работы, произвести расчеты полученных результатов, подготовится к защите работы.
Методические рекомендации
Подготовиться к выполнению практической работы ознакомиться с правилами ТБ и ходом выполнения работы.
Подготовить контрольные вопросы для зачета по практической работе.
Контрольные вопросы:
1. Какие реакции называются обратимыми?
2. Какое состояние системы называется равновесным?
3. Почему химическое равновесие является динамическим?
4. Расскажите о принципе Ле Шателье.
5. Какие факторы влияют на химическое равновесие?
Решение типовых задач:
1. Синтез аммиака является экзотермической реакцией. В какую сторону сместится равновесие системы при повышении температуры?
N2+3H2 ↔ 2NH3+92,4 кДж
2. Синтез оксида азота (II) является эндотермической реакцией. В какую сторону сместится равновесие системы при повышении температуры?
N2+O2 ↔ 2NO-108,5 кДж
3. Куда будет смещаться равновесие системы с увеличением температуры?
N2+O2 ↔ 2NO-108,5 кДж
N2+3H2 ↔ 2NH3+88 кДж
4. Какие реакции идут с повышением давления, а какие - с понижением?
2SO2+O2 ↔ 2SO2
2NO2 ↔ 2NO+O2
H2+I2 ↔ 2HI
5. Как будет меняться равновесие в системах с изменением давления?
N2+3H2 ↔ 2NH3
2HBr ↔ H2+Br2
N2O4 ↔ 2NO2
Самостоятельная работа №11
«Расчет концентрации растворов»
«Экстракция»
Цель: произвести расчет концентрации растворов, ознакомится с методом экстрагирования.
Методические рекомендации
Решить задачи на тему концентрация растворов, ознакомится с материалом учебника и подготовить ответы на контрольные вопросы.
Решение типовых задач:
1. Вычислить молярность раствора глюкозы, если массовая доля С6Н12О6 0,01 (1%). Плотность раствора принять равной единице.
2. Определить нормальность раствора серной кислоты, если массовая доля Н2SО4 0,30 (30%). Плотность раствора равна 1,224 г/см3.
3. Вычислить молярные доли NaOH и воды в водном растворе NaOH концентрации 0,4 (40%) масс. доли.
4. Имеется раствор серной кислоты с массовой долей Н2SО4 0,1 (10%). Вычислить моляльность этого раствора.
5. Вычислить молярные доли воды и спирта в водном растворе спирта, если массовая доля спирта 0,4 (40%).
Литература:
1. Гамеева О.С.,Физическая и коллоидная химия.- М.:Высшая школа, 1977. – 328с.
Контрольные вопросы:
1. Что называют раствором?
2. Какие применяются способы выражения концентрации растворов?
3. В чем суть сольватной теории растворов?
4. Чем вызвано у растворов понижение температуры замерзания и повышения температуры кипения по сравнению с чистым растворителем?
5. Что называется криоскопией и эбулиоскопией?
6. Какая температура называется критической температурой растворения?
7. Что называется экстрагированием?
8. В каких условиях выгодно производить экстрагирование?
9. Какой закон лежит в основе экстрагирования?
10. Какие факторы влияют на растворимость твердых веществ и газов в жидкостях?
Самостоятельная работа №12
Практическая работа № 16
«Разбор строение и заряд коллоидной частицы».
«Подготовка к дифференцированному зачету»
Цель: познакомиться с мицеллярной теорией строения золей. Решить примерный вариант заданий которые будут на дифференцированном зачете.
Методические рекомендации
Ознакомится с материалом учебника и подготовить ответы на контрольные вопросы. Повторить лекции, которые написаны у вас в лекционной тетради, просмотреть конспекты и практические работы.
Литература:
1. Гамеева О.С.,Физическая и коллоидная химия.- М.:Высшая школа, 1977. – 328с.
Контрольные вопросы:
1. Каково строение коллоидных частиц?
2. Чем такое строение объясняется и как оно отражается на свойствах коллоидных растворов?
4 Тренировочный тест для дифференцированного зачета
Вопрос 1. Чему равна универсальная газовая постоянная?
A. 8,314 Дж/моль К
B. 7,832 моль
C. 22,4 м
D. 101325 Па
Вопрос 2. Способность веществ поглощать теплоту при нагревании - это........
A. тепловой эффект
B. теплоёмкость
C. теплопередача
D. работа
Вопрос 3. Нормальные условия - это.......
A. температура 0 градусов Цельсия , давление 101325 Па
B. объём 22,4 м ,температура 25 градусов Цельсия
C. атмосферное давление 750 мм.рт.ст
D. влажность 60 процентов
Вопрос 4. Систему, которая не обменивается веществом с окружающей средой называют:
A. открытой
B. закрытой
C. изолированной
D. замкнутой
Вопрос 5. Энергия не исчезает бесследно и не возникает из ничего, а лишь переходит из одной формы в другую в строго эквивалентных количествах - это
A. 2 закон термодинамики
B. Закон Гесса
C. Закон сохранения энергии
D. Закон Кирхгофа
Вопрос 6. Невозможен процесс, единственным результатом которого было бы превращение теплоты в работу:
A. Закон Бойля Мариотта
B. 2 закон термодинамики
C. Закон Рауля
D. Закон Дальтона
Вопрос 7. Количество выделившейся или поглотившейся теплоты при образовании 1 моля его из простых веществ называют:
A. теплотой сгорания
B. теплотой образования
C. теплотой растворения
D. вязкостью
Вопрос 8. Взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы изучает....
A. электрохимия
B. термодинамика
C. термохимия
D. молекулярно-кинетическая теория
Вопрос 9. Массовая теплоёмкость - это.....
A. количество теплоты, необходимое для нагревания 1 киломоля вещества на 1 градус
B. количество теплоты, необходимое для нагревания 1 кг вещества на 1 градус
C. количество теплоты, необходимое для нагревания на один градус массы вещества, заключённого в 1 м3 газа пр н.у.
D. предел средней теплоёмкости
Вопрос 10. Как обозначается энтальпия:
A. S
B. Н
C. А
D. R
Вопрос 11. Единицы измерения молярной теплоёмкости?
A. кДж/ кмоль К
B. кДж/мК
C. Дж
D. К
Вопрос 12. Как градусы Цельсия перевести в Кельвины?
A. +273
B. +453
C. +0
D. 768
Вопрос 13. Какой буквой обозначается концентрация?
A. C
B. h
C. Р
D. V
Вопрос 14. При постоянном давлении объёмы данной массы газа прямо пропорциональны абсолютным температурам. Это закон......
A. Гей-Люссака
B. Шарля
C. Авогадро
D. Ван-дер-Ваальса
Вопрос 15. При постоянном объёме давления данной массы газа прямо пропорционально абсолютным температурам. Это закон....
A. Шарля
B. Дальтона
C. Рауля
D. Бойля-Мариотта
Вопрос 16. Уравнение состояния Клапейрона - Менделеева для n киломолей идеального газа:
A. РV=RТ
B. РV= НRТ
C. РV=RNn
D. РV=nRТ
Вопрос 17. Название буквы, обозначающей коэффициент поверхностного натяжения?
A. альфа
B. бета
C. сигма
D. гамма
Вопрос 18. Название буквы, обозначающей динамическую вязкость?
A. омега
B. пи
C. альфа
D. эта
Вопрос 19. Прибор, используемый для измерения коэффициента поверхностного натяжения - это
A. сталагмометр
B. термометр
C. манометр
D. вискозиметр
Вопрос 20. Метод, служащий для определения коэффициента поверхностного натяжения -
A. Сталагмометрический
B. Вискозиметрический
C. Хромато графический
D. Потенциометрический
Вопрос 21. Метод для определения вязкости-
A. Вискозиметрический
B. Сталагмометрический
C. Потенциометрический
D. Хроматографический
Вопрос 22. Изотермический-процесс ,протекающий........
A. при постоянной температуре
B. при постоянном объёме
C. при постоянном давлении
D. при постоянном давлении и температуре
Вопрос 23. Изобарический -процесс, протекающий ......
A. при постоянном давлении
B. при постоянной температуре
C. при постоянном объёме
D. при постоянном объёме и температуре
Вопрос 24. Изохорический - процесс, протекающий при ......
A. постоянном объёме
B. постоянной температуре
C. постоянном давлении
D. постоянном давлении и температуре
Вопрос 25. Процесс, в результате которого состояние системы претерпевает ряд изменений ,возвращаясь к исходному называется....
A. круговым
B. не самопроизвольным
C. открытым
D. самопроизвольным
Вопрос 26. Тела, находящиеся за пределами термодинамической системы -это
A. окружающая среда
B. термодинамическая система
C. изолированная система
D. адиабатно - изолированная система
Вопрос 27. Какой буквой обозначается работа
A. А
B. В
C. v
D. М
Вопрос 28. Какой буквой обозначается теплота
A. Q
B. А
C. В
D. М
Вопрос 29. Нормальное давление -........
A. 101325 Па
B. 20 Па
C. 150464 Па
D. 5000 Па
Вопрос 30. Какой буквой обозначается объём
A. V
B. Т
C. М
D. ф
Вопрос 31. Какой буквой обозначается термодинамическая температура
A. Т
B. V
C. А
D. М
Вопрос 32.Какой буквой обозначается число молей
A. n
B. а
C. v
D. д
Вопрос 33. Какой буквой обозначается молярная масса вещества
A. М
B. W
C. J
D. L
Вопрос 34. Какой буквой обозначается универсальная газовая постоянная
A. R
B. А
C. М
D. F
Вопрос 35. Закон Шарля, Гей-Люссака ,Бойля-Мариотта-это
A. газовые законы
B. законы термодинамики
C. основные законы термохимии
D. законы коллоидной химии
Вопрос 36. Робщ =Р1+Р2+Р3+......- это закон
A. Дальтона
B. Шарля
C. Авогадро
D. 1 закон термодинамики
Вопрос 37. Основным законом идеальных газовых смесей является закон.......
A. Дальтона
B. Шарля
C. Гесса
D. Рауля
Вопрос 38. Какое уравнение состояния характеризует поведение реальных газов
A. Ван-дер-Ваальса
B. Рауля
C. Шарля
D. Гей-Люссака
Вопрос 39. В равных объёмах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Это закон
A. Авогадро
B. Гесса
C. Шарля
D. Бойля-Мариотта
Вопрос 40. Как перевести 20 литров в кубические метры
A. 20 умножить на десять в минус третьей степени
B. 20 умножить на десять в квадрате
C. 20 умножить на десять
D. 20 умножить на 5
Вопрос 41. Паскаль - это единица измерения ............
A. давления
B. температуры
C. объёма
D. работы
Вопрос 42. Как изменяется вязкость с повышением температуры
A. уменьшается
B. увеличивается
C. не изменяется
D. исчезает
Вопрос 43. Как перевести мм.рт.столба в паскали
A. умножить на 133,3
B. умножить на 2
C. умножить на 100
D. умножить на 1
Вопрос 44. РV=m/М RТ
A. уравнение Менделеева -Клапейрона
B. Шарля
C. Гей-Люссака
D. Бойля Мариотт
Вопрос 45. Под химическим сродством понимают.......
A. Способность веществ вступать в химическое взаимодействие друг с другом
B. Способность веществ обмениваться ионами
C. Способность веществ выделять теплоту
D. Способность к поглощению теплоты
Вопрос 46. Правило фаз Гиббса для неконденсированной системы
A. Ф+С=К+2
B. Ф+С= 1
C. Ф+ н=К
D. К+С=Ф
Вопрос 47. Какой буквой обозначается Число независимых компонентов в правиле фаз Гиббса
A. К
B. С
C. Х
D. Л
Вопрос 48. Какой буквой обозначается число степеней свободы в правиле фаз Гиббса
A. С
B. Ф
C. К
D. д
Вопрос 49. Как называется однородная система
A. гомогенная
B. физико-химическая
C. гетерогенная
D. изолированная
Вопрос 50. Обратимые - это реакции..........
A. протекающие в одних и тех же условиях в противоположных направлениях
B. идущие до конца
C. идущие в присутствии катализатора
D. идущие с образованием труднорастворимых осадков
Список литературы:
Горшков В.И., Кузнецов И.А., Основы физической химии.- М.: БИНОМ. Лаборатория знаний, 2006. – 407с.
Еремин В.В., Каргов С.И., Успенская И.А. Задачи по физической химии. – М.: Экзамен, 2005. – 320 с.
Бурухин С.Б. Основные закономерности физико-химических процессов: Обнинск. ИАТЭ, 2001. - 173 с.
Байрамов В.М. Основы электрохимии.- М.: Академия,2005. – 240с. – 25 экз.
Фролов Ю.Г. Курс коллоидной химии: Поверхностные явления и дисперсные системы. М.: Химия, 2004. – 464 с.
Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия. СПБ.: Издательство «Лань», 2003. – 336 с.
Зимон А.Д. Коллоидная химия, – М.: Агар, 2003. – 320 с.
Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Высшая школа, 2003. – 527 с.
Карякин Н.В. Основы химической термодинамики. М.: Академия, 2003. – 753 с.
Киреев В.А. Курс физической химии.- М.: Химия, 1975.
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия, М.: Высш. шк., 2007.- 444 с.
Воюцкий С.С. Курс коллоидной химии. М.: Химия, 1975.
Бурухин С.Б. Поверхностные явления. Обнинск. ИАТЭ, 2003. – 120 с.
1












