| Соли – это ионные соединения, при попадании в воду они диссоциируют на ионы. В водном растворе эти ионы ГИДРАТИРОВАНЫ – окружены молекулами воды. Обнаружено, что водные растворы многих солей имеют не нейтральную среду, а либо слабокислую, либо щелочную. Объяснение этого – взаимодействие ионов соли с водой. Этот процесс называется ГИДРОЛИЗОМ.
Катионы и анионы, образованные слабым основанием или слабой кислотой, взаимодействуют с водой, отрывая от нее Н или ОН. Причина этого: образование БОЛЕЕ ПРОЧНОЙ связи, чем в самой воде.
По отношению к воде соли можно разделить на 4 группы:
1) Соль, образованная сильным основанием и сильной кислотой - НЕ ГИДРОЛИЗУЕТСЯ, в растворе только диссоциирует на ионы. Среда нейтральная.
ПРИМЕР: Не гидролизуются соли – NaCl, KNO3, RbBr, Cs2SO4, KClO3, и т.п. В растворе эти соли только диссоциируют: Cs2SO4 2Cs++SO42
2) Соль, образованная сильным основанием и слабой кислотой - гидролиз ПО АНИОНУ. Анион слабой кислоты отрывает от воды ионы водорода, связывает их. В растворе образуется избыток ионов ОН- - среда щелочная.
ПРИМЕР: Гидролизу по аниону подвергаются соли - Na2S, KF, K3PO4 , Na2CO3, Cs2SO3, KCN, KClO, и кислые соли этих кислот. K3PO4 – соль, образованная слабой кислотой и сильным основанием. Гидролизуется фосфат-анион. PO43- + НОН ⇄ НРО42-+ОН- K3PO4 + Н2О ⇄ К2НРО4 + КОН (это первая ступень гидролиза, остальные 2 идут в очень малой степени) 3) Соль, образованная слабым основанием и сильной кислотой - гидролиз ПО КАТИОНУ. Катион слабого основания отрывает от воды ион ОН-, связывает его. В растворе остаётся избыток ионов H+ - среда кислая.
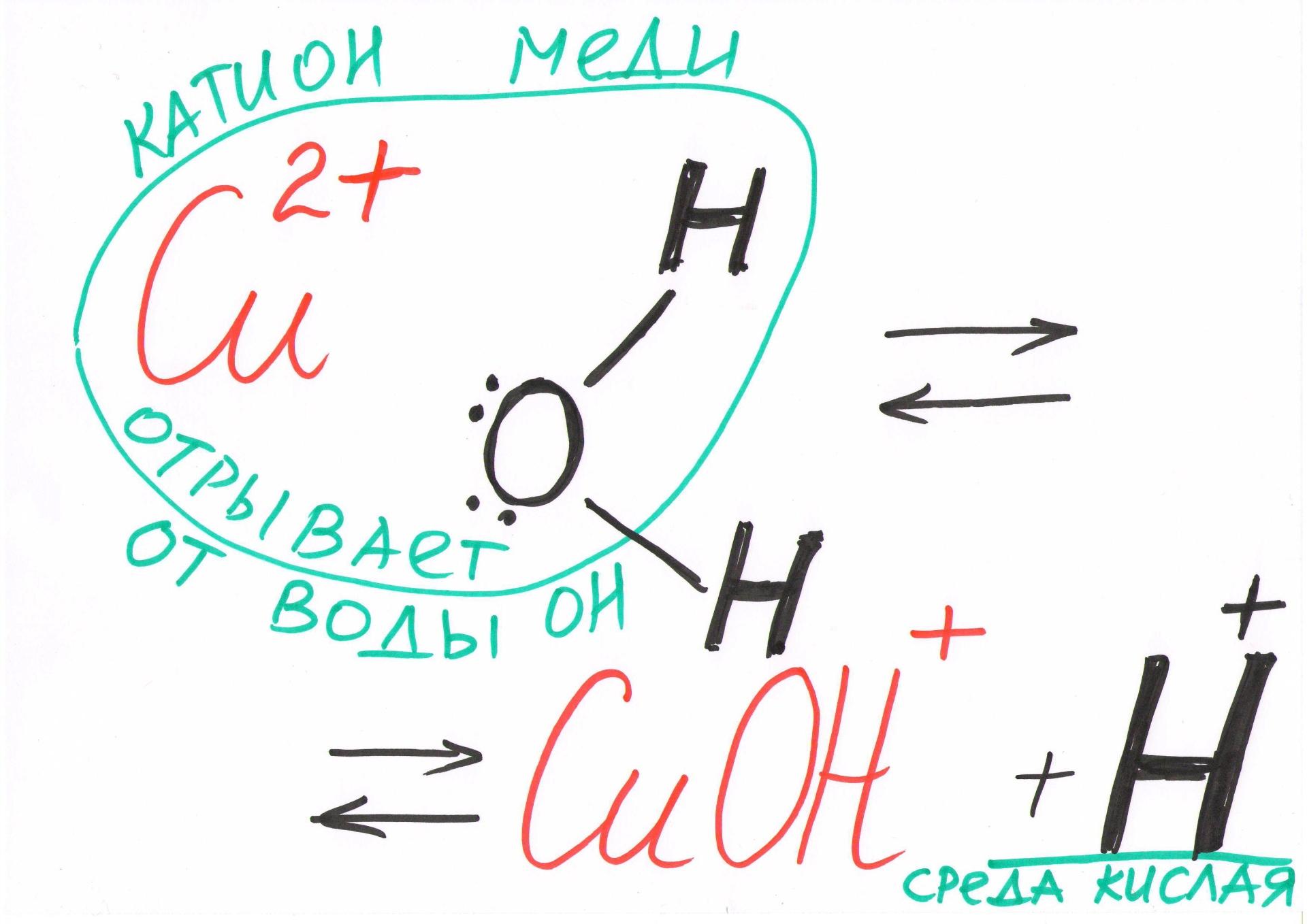
ПРИМЕР: Гидролизу по катиону подвергаются соли - CuCl2, NH4Cl, Al(NO3)3, Cr2(SO4)3 . CuSO4 – соль, образованная слабым основанием и сильной кислотой. Гидролизуется катион меди: Cu+2 + НОН ⇄ CuOH+ +H+ 2CuSO4+2H2O ⇄ (CuOH)2SO4 + H2SO4
4) Соль, образованная слабым основанием и слабой кислотой - гидролиз И ПО КАТИОНУ И ПО АНИОНУ. Если какие-либо из продуктов выделяются в виде осадка или газа, то гидролиз необратимый, если оба продукта гидролиза остаются в растворе - гидролиз обратимый.
ПРИМЕР: Гидролизуются соли – Al2S3 + H2O Al(OH)3 + H2S
NH4F + H2O ⇄NH4OH + HF
Взаимный гидролиз двух солей.
Он происходит при попытке получить с помощью обменной реакции солей, которые в водном растворе полностью гидролизованы. При этом происходит взаимный гидролиз – т.е. катион металла связывает ОН-группы, а анион кислоты – Н+
1) Соли металлов со степенью окисления +3 и соли летучих кислот (карбонаты, сульфиды, сульфиты) – при их взаимном гидролизе образуется осадок гидроксида и газ: 2AlCl3 + 3K2S + 6H2O 2Al(OH)3 + 3H2S↑ + 6KCl (Fe3+, Cr3+) (SO32-, CO32-) (SO2, CO2)
2) Соли металлов со степенью окисления +2 (кроме кальция, стронция и бария) и растворимые карбонаты также вместе гидролизуются, но при этом образуется осадок ОСНОВНОГО КАРБОНАТА металла: 2 CuCl2 + 2Na2CO3 + H2O (CuOH)2CO3 + CO2 + 4 NaCl (все 2+, кроме Са, Sr, Ba)
Характеристика процесса гидролиза: 1) Процесс гидролиза является обратимым, протекает не до конца, а только до момента РАВНОВЕСИЯ; 2) Процесс гидролиза – обратный для реакции НЕЙТРАЛИЗАЦИИ, следовательно, гидролиз - эндотермический процесс (протекает с поглощением теплоты). KF + H2O ⇄ HF + KOH – Q
Какие факторы усиливают гидролиз? Нагревание – при увеличении температуры равновесие смещается в сторону ЭНДОТЕРМИЧЕСКОЙ реакции – гидролиз усиливается; Добавление воды – т.к. вода является исходным веществом в реакции гидролиза, то разбавление раствора усиливает гидролиз.
Как подавить (ослабить) процесс гидролиза? Часто необходимо не допустить гидролиза. Для этого: Раствор делают максимально концентрированным (уменьшают количество воды); Для смещения равновесия влево добавляют один из продуктов гидролиза – кислоту, если идёт гидролиз по катиону или щёлочь, если идёт гидролиз по аниону.
Пример: как подавить гидролиз хлорида алюминия? Хлорид алюминия AlCl3 – это соль, образованная слабым основанием и сильной кислотой – гидролизуется по катиону: Al+3 + HOH ⇄ AlOH +2 + H+ Среда – кислая. Следовательно, для подавления гидролиза необходимо добавить еще кислоты. Кроме того, следует сделать раствор наиболее концентрированным. | 

















