Часть 1. Классификация неорганических веществ.
Часть 2. Оксиды.
Часть 3. Основания.
Часть 4. Амфотерные гидроксиды.
Часть 1.Классификация неорганических веществ.
К важнейшим классам неорганических веществ по традиции относят:
простые вещества (металлы и неметаллы),
оксиды (кислотные, основные и амфотерные),
гидроксиды (часть кислот, основания, амфотерные гидроксиды),
соли.
Простые вещества обычно делят на металлы и неметаллы.
Металлы – простые вещества, в которых атомы связаны между собой металлической связью.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
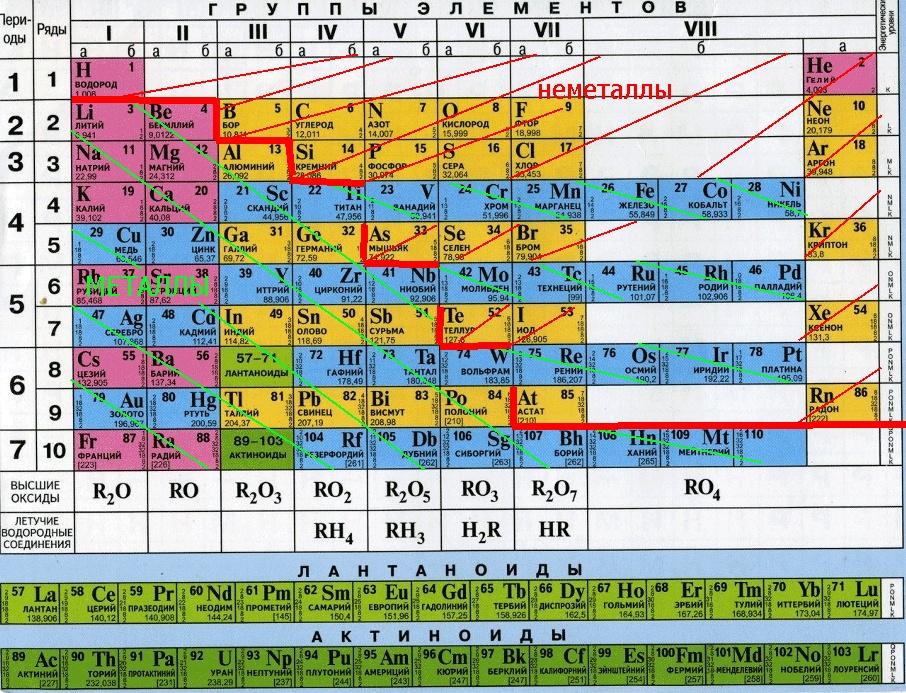
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов.
Это название отражает способность этих металлов, их оксидов и гидроксидов реагировать как с кислотами, так и со щелочами.
Оксиды – бинарные соединения, одним из двух элементов в которых является кислород со степенью окисления -2.
| Основные | Амфотерные | Кислотные | Несолеобразующие | Солеобразные (двойные) |
| Оксиды металлов в степенях окисления +1, +2, кроме амфотерных. | Оксиды металлов в степенях окисления +2: толькоBe, Zn, Sn, Pb; +3 (все, кроме La2O3), +4 | 1) Оксиды неметаллов, кроме несолеобразующих; 2) Оксиды металлов в степенях окисления от +5 и выше. | Оксиды неметаллов, которым не соответствуют кислоты.
NO, N2O, CO, (SiO) | Некоторые оксиды, в которых элемент имеет 2 степени окисления: Fe3O4
|
| С о л е о б р а з у ю щ и е |
|
|
Каждому солеобразующему оксиду соответствует гидроксид:
Основным оксидам соответствуют основания;
Амфотерным оксидам – амфотерные гидроксиды,
Кислотным оксидам – кислородсодержащие кислоты.
Гидроксиды – соединения, в состав которых входит группа Э–О-Н. И основания, и кислородсодержащие кислоты, и амфотерные гидроксиды – относятся к ГИДРОКСИДАМ!

Связь между оксидом и гидроксидами.
| Степень окисления |
Оксид | Гидроксиды |
Примеры |
| Основания | Кислоты |
| +1 | Э2О | ЭОН | НЭО | КОН | НClO |
| +2 | ЭО | Э(ОН) 2 | Н2ЭО2 | Ba(OH) 2 | ? |
| +3 | Э2О3 | Э(ОН) 3 | НЭО2 (мета-форма) --(+H2O) Н3ЭО3 (орто-форма) | Al(OH) 3 | HNO2 H3PO3 |
| +4 | ЭО2 | ----- | H2ЭО3 H 4ЭO 4 | ----- | Н2СО3 H 4SiO 4 |
| +5 | Э2О5 | ----- | НЭО3 Н3ЭО4 | ----- | HNO3 H3PO4 |
| +6 | ЭО3 | ----- | H2ЭO4 | ----- | H2SO4 |
| +7 | Э2О7 | ----- | НЭО4 --(+ 2H2O) H 5ЭО6 | ----- | HClO4 H5IO6 |
КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
А. Если чётная степень окисления элемента в оксиде: ПРИБАВЛЯЕМ ВОДУ к оксиду. Пример: WO3 –(+H2O) H2WO4
Б. Если нечетная степень окисления:
| Мета-форма кислоты - ОДИН атом водорода: НЭОх | Орто-форма кислоты – отличается от МЕТА-формы на одну молекулу воды. Н3ЭОх+1 |
Пример: Оксид As2O5, степень окисления мышьяка +5.
Составим формулу кислоты: Н+As+5O-2x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO3 Это МЕТА-форма кислоты - мета-мышьяковая кислота.
Но для фосфора и мышьяка существует и более устойчива ОРТО-форма. Прибавив к мета-форме Н2О, получим H3AsO4. Это орто-
мышьяковая кислота.
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН- и при диссоциации образующие в качестве анионов только эти ионы.
Типы оснований
| Растворимые (Щелочи) | Нерастворимые |
| 1) гидроксиды металлов первой группы главной подгруппы: LiOH, NaOH, KOH, RbOH, CsOH 2) гидроксиды металлов второй группы главной подгруппы, начиная с кальция: Ca(OH)2, Sr(OH)2, Ba(OH)2 | Все остальные гидроксиды металлов. |
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле:
однокислотные – содержащие только 1 гидроксогруппу
двухкислотные – имеющие 2 гидроксогруппу;
трёхкислотные – с тремя группами ОН.
Кислоты – сложные вещества, содержащие в своем составе ионы оксония Н+ или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Классификация кислот по составу.
| Кислородсодержащие кислоты | Бескислородные кислоты |
| 1) высшие кислоты H2SO4 серная кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота 2) кислоты с меньшей степенью окисления неметалла H2SO3 сернистая кислота HNO2 азотистая кислота | HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
Классификация кислот по числу атомов водорода.
| Одноосновные | Двухосновные | Трехосновные |
| HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
Классификация по силе и устойчивости
| Сильные кислоты | Слабые кислоты |
| HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная HClO4 хлорная | HF фтороводородная H3PO4 фосфорная HNO2 азотистая (неустойчивая) H2SO3 сернистая (неустойчивая) H2CO3 угольная (неустойчивая) H2S↑ сероводородная H2SiO3↓ кремниевая СН3СООН уксусная |
Соли – это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+) и одного (или нескольких) кислотных остатков.
Классификация солей.
| СОЛИ |
| Средние | Кислые | Основ-ные | Двойные | Сме-шанные | Комплексные |
| Продукт полного замещения атомов водорода в кислоте на металл | Продукт непол-ного замещения атомов водоро-да в кислоте на металл | Продукт непол-ного заме-щения ОН-групп на кислотный остаток | Содержат два разных металла и один кислотный остаток
| Содер-жат один металл и два кислотных остатка | Содержат комплексный катион или анион – атом металла, связанный с несколькими лигандами. |
| AlCl3 | КHSO4 | FeOHCl | KAl(SO4)2 | CaClBr | K2[Zn(OH)4] |
| Хлорид алюминия | Гидросульфат калия | Хлорид гидроксожелеза (II) | Сульфат алюминия-калия | Хлорид-бромид кальция | Тетрагидроксоцинкат калия |
Номенклатура солей. В названиях солей используются латинские названия образующих кислоты неметаллов.
| Элемент | Латинское название | Корень |
| Н | гидрогениум | ГИДР- |
| С | карбоникум | КАРБ- |
| N | нитрогениум | НИТР- |
| S | сульфур | СУЛЬФ- |
Построение названий солей.
|
| Соль какой кислоты | Кислотный остаток | Название солей | Примеры
|
| Высшие кислоты | Азотная HNO3 | NO3- | нитраты | Ca(NO3)2 нитрат кальция |
| Кремниевая H2SiO3 | SiO32- | силикаты | Na2SiO3 силикат натрия |
| Угольная H2CO3 | CO32- | карбонаты | Na2CO3 карбонат натрия |
| Фосфорная H3PO4 | PO43- | фосфаты | AlPO4 фосфат алюминия |
| Серная H2SO4 | SO42- | сульфаты | PbSO4 сульфат свинца |
| Бескислородные кислоты | Бромоводородная HBr | Br- | бромиды | NaBr бромид натрия |
| Иодоводородная HI | I- | иодиды | KI иодид калия |
| Сероводородная H2S | S2- | сульфиды | FeS сульфид железа (II) |
| Соляная HCl (хлороводородная) | Cl- | хлориды | NH4Cl хлорид аммония |
| Фтороводородная HF | F- | фториды | CaF2 фторид кальция |
| Более низкая степ. ок. | Cернистая кислота H2SO3 | SO32- | сульфиты | К2SO3 сульфит калия |
| Азотистая HNO2 | NO2- | нитриты | КNO2 нитрит калия |
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку "гидро": NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы. Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки "гидроксо":
Mg(OH)Cl - гидроксохлорид магния (основная соль)
Двойные соли – имеют два разных катиона металла или аммония. В названии их перечисляют через дефис:
(NH4)Fe(SO4)2 – сульфат железа (III)-аммония.
Смешанные соли – имеют два разных аниона кислотных остатков. В названии их называют через дефис: СаOCl2 или CaCl(OCl) - хлорид-гипохлорит кальция (традиционное название хлорная известь).
Комплексные соли – содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
Пример: K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II)
Бытовые (тривиальные) названия некоторых солей.
| Соль | Международное название | Традиционное название |
| NaHCO3 | Гидрокарбонат натрия | Сода питьевая |
| Na2CO3 | Карбонат натрия | Сода кальцинированная |
| K2CO3 | Карбонат калия | Поташ |
| Na2SO4 | Сульфат натрия | Глауберова соль |
| KClO3 | Хлорат калия | Бертолетова соль |
| Ca3(PO4)2 | Фосфат кальция | Фосфорит |
| СаСО3 | Карбонат кальция | Известняк |
| CuSO4∙5H2O | Пентагидрат сульфата меди | Медный купорос |
| Na2CO3∙10Н2О | Декагидрат карбоната натрия | Сода кристаллическая |
Часть 2. Оксиды, получение и свойства. Получение оксидов:
| Способы получения. | Примеры. | Ограничения и примечания |
| 1. Окисление простых веществ: | а) металлов: 2Ca + O2 2CaO б) неметаллов: 4P + 3O2 (нед) 2P2O 3 4P + 5O2 (изб) 2P2O5 (Из S – SO2, из Fe – Fe2O3 и Fe3O4, из N2 – NO) | С кислородом не реагируют галогены, инертные газы, Au, Pt. Азот реагирует в жестких условиях (2000°C). |
| 2. Окисление сложных веществ: | а) водородных соединений: 2Н2S + 3O 2 2H2O + 2SO 2 б) сульфидов, карбидов, фосфидов (бинарных соединений): 2ZnS + 3O2 2ZnO + 2SO2 | Каждый элемент сложного вещества окисляется в соответствии со своими свойствами. |
| 3. Разложение гидроксидов и солей: | а) гидроксидов (оснований и кислот):2Al(OH)3→ t Al2O3 + 3H2O H2SiO3 → t SiO2 + H2O б) карбонатов: СаСО3→ t CaO+CO2 | Гидроксиды и карбонаты щелочных металлов (Na,K, Rb,Cs) не разлагаются. |
| 4. Окисление кислородом или озоном | а) кислородом: 2СО + О2 2СО2 б) озоном: NO + O3 NO2 + O2 | Возможна, если элемент имеет несколько оксидов (сера, фосфор, углерод, азот, железо). |
СВОЙСТВА ОКСИДОВ.
Основные оксиды – оксиды, которым соответствуют основания. Это оксиды металлов со степенями окисления +1 и +2, кроме амфотерных (ZnO, BeO, SnO, PbO)
Свойства основных оксидов.
| Свойства | Примеры реакций | Ограничения и примечания |
| 1) Реакция с растворами кислот | Li2O + 2HCl= 2LiCl+ H2O NiO + H2SO4 = NiSO4 + H2O | Кислота должна существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная) |
| 2) Реакция с водой | Li2O + H2O = 2LiOH BaO + H2O = Ba(OH)2 (только 8 оксидов: IA группа, СаО, SrO, ВаО) | Оксид реагирует с водой, только если в результате образуется растворимый гидроксид (щелочь). |
| 3) Реакция с кислотными и амфотерными оксидами | BaO + CO2 = BaCO3, FeO + SO3 = FeSO4, CuO + N2O5 = Cu(NO3) 2 СаО + SO2 = CaSO3 | Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду. |
| 4) Восстановление оксида до металла или до низшего оксида: | MnO + C = Mn + CO (при нагревании), FeO + H2 = Fe + H2O (при нагревании). Fe2O3 + CO = FeO + CO2 | В качестве восстановителей используют: СО, С, водород, алюминий, магний. С водородом реагируют оксиды неактивных металлов. |
| 5) Окисление кислородом. | 4FeO + O2 = 2Fe2O3 | Если металл имеет несколько оксидов с разными степенями окисления. |
Кислотные оксиды – оксиды, которым соответствуют кислоты.
Кислотные оксиды при комнатной температуре бывают:
*газы (например: СО2, SO2, NO, SeO2)*жидкости (например, SO3, Mn2O7) *твердые вещества (например: B2O3, SiO2, N2O5, P2O3, P2O5, I2O5, CrO3).
Свойства кислотных оксидов.
| Свойства | Примеры реакций | Примечания |
| 1) Реакция с основа-ниями | CO2 + Ca(OH) 2 = CaCO3 + H2O SiO2 + 2KOH = K2SiO3 + H2O (при нагревании), SO3 + 2NaOH = Na2SO4 + H2O, N2O5 + 2KOH = 2KNO3 + H2O. | Реакция возможна со щелочами. Наиболее активные кислотные оксиды (SO3, CrO3, N2O5, Cl2O7) могут реагировать и с нерастворимыми (слабыми) основаниями. |
| 2) Реакция с амфотер-ными и основными оксидами | CO2 + CaO = CaCO3 P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании) N2O5 + ZnO = Zn(NO3)2 | Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду. |
| 3) Реакция с водой. Образуют-ся КИСЛОТЫ. | N2O3 + H2O = 2HNO2 SO2 + H2O = H2SO3 N2O5 + H2O = 2HNO3 SO3 + H2O = H2SO4 | Оксид реагирует с водой, если в результате образуется растворимый гидроксид. Не реагирует с водой SiO2. |
| 4) Реакции с солями летучих кислот. | SiO2 + K2CO3 = K2SiO3 + CO2 (при нагревании)
| Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие. |
| 5) Окисле-ние. | 2SO2 + O2 ⇆ 2SO3 | Низшие оксиды окисляются до высших. |
Амфотерные оксиды – оксиды, способные реагировать и с кислотами, и со щелочами. По химическим свойствам амфотерные оксиды похожи на основные оксиды и отличаются от них только своей способностью реагировать с щелочами, как с твердыми (при сплавлении), так и с растворами, а также с основными оксидами.
Вещества, образуемые катионами амфотерных металлов в щелочной среде:
| Степень окисления | В растворе | В расплаве |
| +2 (Zn, Be, Sn) | Na 2[Zn (OH) 4] тетрагидроксоцинкат натрия | Na2ZnO2 цинкат натрия |
| +3 (Al, Cr, Fe*)
| Na[Al(OH)4] тетрагидроксоалюминат натрия Na3[Al(OH)6] гексагидроксоалюминат натрия | NaAlO2 метаалюминат натрия и Na3AlO3 ортоалюминат натрия |
| *) железо не образует устойчивых гидроксокомплексов, амфотерно только в расплаве, образуя NaFeO2 |
СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ.
| Cвойства | Примеры реакций | Примечания |
| 1) Реагируют с кислотами, так же, как основные оксиды – образуются соли. | ZnO + 2HCl = ZnCl2 + H2O Al2O3 + 6HNO3 = 2Al(NO3)3 +3H2O | Только с сильными кислотами |
| 2) Взаимодействуют с растворами щелочей – образуются растворы гидроксокомплексов. | Al2O3 + 2KOH +3H2O = 2K[Al(OH)4] или K3[Al(OH)6] ZnO +2NaOH +H2O=Na2[Zn(OH)4] |
|
| 3) Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов. | Al2O3 + 2KOH → t 2KAlO2 + H2O (или K3AlO3) ZnO + 2KOH → t K2ZnO2 + H2O |
|
| 4) При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами. | Al2O3 + Na2CO3 → t 2NaAlO2+CO2 (или Na3AlO3) ZnO + Na2CO3 → t Na2ZnO2+ CO2 |
|
Часть 3. Основания.
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы или при взаимодействии с водой образующие эти ионы в качестве анионов.
Щелочи – растворимые основания, в водном растворе создают щелочную среду засчёт иона ОН-, который образуется при их ДИССОЦИАЦИИ: KOH K+ + OH-
Нерастворимые основания в водном растворе щелочную среду не создают!
Получение оснований:
| Способ получения | Примеры реакций | Примечания |
| 1) Реакция активных металлов с водой (только если образуется растворимый гидроксид!) | 2Na + 2H2O = 2NaOH + H2 | С водой реагируют металлы IA подгруппы, Са, Sr, Ba |
| 2) Взаимодействие основных оксидов с водой (только если образуется растворимый гидроксид!) | ВаО + Н2О = Ва(ОН)2 | С водой реагируют оксиды металлов IA подгруппы, Са, Sr, Ba. |
| 3) Электролиз растворов хлоридов и бромидов щелочных металлов. | 2KCl + 2H2O �\s\up9(эл.ток� Cl2+ H2 + 2KOH |
|
| 4) Обменные реакции в растворе. | Ba(OH)2 + Na2SO4 = BaSO4 ↓+ 2NaOH | Исходные вещества должны быть растворимы!В продуктах должен быть осадок! |
| 5) Взаимодействие солей тяжелых металлов со щелочами. | СuCl2 + 2KOH = Сu(OH)2 + 2KCl | Получение нерастворимых гидроксидов. |
СВОЙСТВА ОСНОВАНИЙ:
1. Свойства щелочей – растворимых оснований.
| 1) Взаимодействие с кислотами – реакция нейтрализации | NaOH + HNO2 = NaNO2 + H2O |
| 2) С кислотными оксидами. В зависимости от соотношения щелочи и оксида получаются средние и кислые соли | SiO2(тв.)+ 2NaOH → t Na2SiO3 + +H2O 2NaOH (избыток) + CO2 = Na2CO3 + H2O NaOH+ CO2(избыток) = NaНCO3 |
| 3)Реакция с растворами средних солей. | 2NaOH + FeSO4 = Fe(OH)2↓+ Na2SO4 2KOH + (NH4)2SO4 = K2SO4 + 2NH3+ 2H2O Исходные вещества должны быть растворимы, в продуктах - газ или осадок. |
| 3*) Соль амфотерного металла со щелочью.
| AlCl3 + 3KOH(недостаток) = Al(OH)3↓ + 3KCl AlCl3 + 4KOH(избыток) = 3KCl + K[Al(OH)4] В зависимости от количества щелочи может образовывать гидроксид или гидроксокомплекс. |
| 4) Реакция с кислыми солями – образуется средняя соль или менее кислая. | NaOH + NaHCO3 = H2O + Na2CO3 КОН + КН2РО4 = К2НРО4+H2O |
| 5) Реакция с амфотерными оксидами и гидроксидами. | 2NaOH + Cr2O3 → t 2NaCrO2 + H2O (сплавление) Раствор: 2KOH + ZnO +H2O=K2[Zn(OH)4] 2NaOH +Zn(OH)2=Na2[Zn(OH)4] 3KOH + Cr(OH)3 = K3[Cr(OH)6] |
| 6) Реакция с амфотерными металлами | 2NaOH + Zn +2H2O = Na2[Zn(OH)4] + H2 (кроме Fe и Cr) |
| 7) Взаимодействие с неметаллами (кроме N2, C, O2, инертных газов): | 2F2 + 4NaOH = O2 + 4NaF + 2H2O Si + 2KOH + H2O = K2SiO3 + 2H2 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O– реакция диспропорционирования (S,P,Cl2,Br2,I2). |
| 8) Щелочи (кроме LiOH) при нагревании не разлагаются. | 2LiOH –(t) Li2O + H2O |
2. Свойства нерастворимых оснований.
| 1) Взаимодействие с сильными кислотами – реакция нейтрализации. | Fe(OH) 2+2HCl =FeCl2 + 2H2O |
| 2) Реакция с кислотными оксидами (только очень сильных кислот – SO3,N2O5, Cl2O7) | Cu(OH)2 + N2O5 → t Cu(NO3)2 |
| 3) Разложение при нагревании. | Сu(OH)2 → t CuO + H2O AgOH распадается сразу в момент получения. |
| 4) Окисление низших неустойчивых оснований кислородом. | 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 2Mn(OH)2 + O2 = 2MnO2 + 2H2O |
Часть 4. Амфотерные гидроксиды
– это гидроксиды, которые могут в зависимости от условий проявлять как кислотные, так и основные свойства (двойственный характер).
+2: Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2
+3: Al(OH)3, Cr(OH)3, [Fe(OH)3–слабо амфотерный, не образует гидроксокомплексов, реагирует со щелочами только в сплаве!]
Получение амфотерных гидроксидов.
| 1) Реакции растворов солей со щелочью в недостатке: ZnCl2 + NaOH (недостаток) = Zn(OH)2↓ + 2NaCl |
| 2) Реакции взаимного гидролиза солей Al+3 ,Cr+3 , Fe+3 и солей летучих кислот: 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓+3CO2+ 6NaCl (SO32-,S2-) |
| 3) Выделение из гидроксокомплекса под действием слабых кислот или их оксидов: K3[Cr(OH)6] + 3CO2 Cr(OH)3 + 3KHCO3 (Al3+) (H2S, SO2) |
Свойства амфотерных гидроксидов.
| Свойства | Примеры реакций | Примечания |
| 1) Реагируют с кислотами, образуются соли. | Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Al(OH)3+3HNO3=Al(NO3)3+ 3H2O | Только с сильными кислотами |
| 2) Взаимо-действуют с растворами щелочей. | 2NaOH+Zn(OH)2=Na2[Zn(OH)4] Тетрагидроксоцинкат натрия. 3KOH+ Cr(OH)3 = K3[Cr(OH)6] Гексагидроксохромат (III) калия | в растворе образуются гидроксокомплексы, кроме железа! |
| 3) Реагируют с расплавами щелочей – образуя соли. | Al(OH)3 + KOH → t KAlO2+ 2H2O (или K3AlO3) Zn(OH)2+2KOH→ t K2ZnO2 + 2H2O |
|
| 4) При сплавлении реагируют с карбонатами щелочных металлов. | 2Al(OH)3+ Na2CO3 = 2NaAlO2 (или Na3AlO3) + CO2+ 3Н2О (при нагревании) Zn(OH)2 + Na2CO3 = Na2ZnO2 + CO2 + Н2О (при нагревании) |
|
| 5) Разлагаются при нагревании | 2Al(OH)3 → t Al2O3 + 3H2O |
|



















