Краткая аннотация к уроку.
Урок составлен для учащихся 10 класса. Большинство учащихся класса выбрали экзамен по химии в формате ЕГЭ. Этим объясняется цель урока. Класс обучается по 2-х часовой программе (автор Габриелян) Это второй урок в блоке изучения нового материала по теме «Кислородосодержащие органические соединения». Урок проведен на семинаре завучей района и учителей химии.
Фрагмент занятия творческой лаборатории.
"Чтобы познать, надо научиться наблюдать"
Урок – практикум: «Спирты. Взаимосвязь органических веществ».
Цели урока: подготовка учащихся к ЕГЭ
по теме «Повторение и обобщение знаний о классе спиртов. Химические свойства спиртов».
Задачи:
1) обучающие:
- повторить особенности строения молекулы одноатомных и многоатомных спиртов;
- изучить химические свойства одноатомных и многоатомных спиртов;
- раскрыть взаимосвязь строения и свойств веществ на примере одноатомных и многоатомных спиртов;
- продолжить формировать навыки самостоятельной работы с учебным материалом с использованием новых информационных технологий;
- продолжить формировать компетенции, касающиеся владения устным и письменным общением;
- продолжить формировать навыки самоконтроля.
2) развивающие:
-развивать у учащихся умения выделять главное, существенное в изучаемом материале; сравнивать;
- развивать самостоятельность учащихся, используя для этого проблемные ситуации, устранение опеки при оказании помощи;
- развивать эмоции и мотивы учащихся, создавая на уроке эмоциональные и мотивационные ситуации;
- способствовать формированию познавательной активности учащихся на уроке через применение медиа-презентаций;
3) воспитывающие:
- содействовать в ходе урока формированию причинно-следственных и межпредметных связей;
- продолжить формирование научного мировоззрения;
- содействовать физическому воспитанию, через напоминание об осанке учащихся во время работы, соблюдения ТБ
Предметно-практическая: Ввести учащихся в ситуацию практического действия. Методом эксперимента сравнить свойства одноатомных и многоатомных спиртов.
Тип урока: изучение нового материала.
Форма урока: урок- презентация
Методы обучения: словесный, работа с учебником и справочником, наглядный, практический.
Место мультимедийной презентации в уроке: иллюстрация изучаемого материала, иллюстрация заданий материалов ЕГЭ по теме. Презентация составлена так, что ученик, пропустивший данный урок, или ученик, которому необходима дополнительная проработка материала, могут воспользоваться ею самостоятельно, работая в компьютерном классе или дома при наличии ПК. Данная презентация может быть использована учащимися 10-11 классов для обобщенного повторения и подготовке к ЕГЭ.
Оборудование и реактивы:
Для учителя:
мультимедийный проектор,
экран, презентация к уроку,
реактивы: этиловый спирт, глицерин, этиленгликоль, медный купорос, щёлочь, люголь, медная проволока.
Дидактический материал (задания части С из ЕГЭ) для индивидуальной работы.
Для обучающихся:
Дидактические материалы для групп
Информационные материалы
Инструкции для выполнения лабораторной работы.
Реактивы и оборудование: р-р яичного белка, этиловый спирт, чистые пробирки, глицерин, этиленгликоль, медный купорос, щёлочь, люголь.
Ход урока: I этап: Организационный момент. Проверка готовности учащихся к уроку.
II этап: Целеполагания . Мотивация к деятельности.
Презентация( 1 слайд) з
Пушкин А. С. - «Виноград»
Не стану я жалеть о роза
Увядших с легкою весной;
Мне мил и виноград на лозах,
В кистях созревший под горой,
Краса моей долины злачной,
Отрада осени златой,
Продолговатый и прозрачный,
Как персты девы молодой.
Учитель: Обсуждение произведение А.С.Пушкина «Виноград»?
Ученики: в VIII веке алхимики умели выделять из вина то вещество, которое придает ему опьяняющее свойство. Это вещество было названо спиртом или алкоголем, и под этими названиями оно известно и ныне. Но вследствие каких причин и как образуется в фруктовом соке этот спирт, еще очень долгое время человечеству не было известно. Лишь в XIX веке (в 1809 году) химик Бехер открыл, что спирт образуется во время брожения сахаристых веществ.

2 слайд
Учитель:
Называется тема урока: «Спирты. Взаимосвязь с органическими веществами». Закрепление знаний, полученных на прошлом уроке, и сравнение свойств одноатомных и многоатомных спиртов.
3 слайд Работа с интерактивной доской.
III этап: Актуализация знаний.
Мотивация к деятельности.
Учитель сообщает учащимся, что оценка сегодня будет выставляться по накопительной системе в конце урока. За каждое правильное решение ученик себе должен поставить балл (самоконтроль).
IV этап: Закрепление материала.
Фронтальный опрос.
Учитель:1Какие же углеводороды называют спиртами? Слушаем ответ учащихся (открываем занавеску на экране.)
2 Как классифицируются спирты? И так, задание части А, подумай и запиши
Из названных веществ:
этандиол, бутанол, этанол, пропаналь, пропантриол, 3-метилбутанол-1
выберите: девочки – многоатомные спирты, мальчики – одноатомные и составьте их структурные формулы.
Проверка: одноатомные спирты: этанол CH3-CH2-OH;
3-метилбутанол -1 CH3-CH-CH2-CH2-OH
CH3

 многоатомные спирты: этандиол CH2 – CH2, п
многоатомные спирты: этандиол CH2 – CH2, п ропантриол CH2 –CH –CH
ропантриол CH2 –CH –CH
OH OH OH OH OH
3Как дать название спиртов?
Проверь себя. Ученики пишут в тетради формулы. Вызываем по одному к доске. Ребята работают с интерактивной доской.
Учитель:
Что общего между водой и спиртами?
4 слайд
Ученики: И у воды и у спирта имеется в наличии водородная связь.
Оказывается, все дело в водородных связях, которые образуются между молекулами спиртов, и не дают отдельным молекулам улететь.
5 слайд
Учитель: Можно ли спирты отнести к кислотам?
Давайте посмотрим опыты. Опыт спиртов с натрием (Видеопыт)
Ученики: так как спирты способны вытеснять водород, то их можно отнести к кислотам.
Учитель: Но вы ещё сомневаетесь, поэтому проверим на индикаторы
Ученики: Работают по инструкциям.
1 группа – этиловый спирт
2 группа- этиленгликоль
3 группа- глицерин
Фенол использовать в школьной лаборатории запрещён.Фенол очень хорошо растворяется в глицерине, поэтому при попадании фенола на кожу для того, чтобы предотвратить ожог, следует обильно смачивать пораженное место глицерином. (Первый признак ожога – побеление кожи.)
Учащиеся делают вывод - спирты имеют нейтральную среду, ароматические слабокислую.
Кислотные свойства спиртов слишком слабы, слабы настолько, что спирты не действуют на индикаторы.
Учитель --Кислотность фенолов значительно выше, чем спиртов и несколько меньше кислотности угольной кислоты. Как следствие, фенол взаимодействует не только с натрием, но и с водным раствором щелочи, растворяясь в нем с образованием фенолята. (Видеопыт)
Учащиеся--Спирты с водной щелочью не реагируют,
фенолы в отличие от спиртов не реагируют с галогеноводородами и не образуют простых эфиров при действии концентрированной H2SO4.
6 слайд
Учитель: Ребята, какими химическими свойствами ещё обладают спирты?
Ученики: Реакция окисления
Ученики выполняют опыты с оксидом меди
Вывод
Ученики: Образуется новое вещество, изменился запах.
Следовательно, образуется альдегид.
Схема пишется на доске.
Опыт видео с оксидом хрома. Опыт с глицерином
Ребята, а дальше процесс может пойти?
Реакция идёт с образованием карбоновых кислот Схема пишется на доске.
Учитель: Вы все знаете, что на дорогах нашей страны стоят защитники закона – полиция. У них есть прибор алколайзер для определения алкоголя в крови. Давайте своими методами, определим наличие спирта.
1 группа – этиловый спирт (люголь и щёлочь)
2 группа- этиленгликоль (сульфат меди и щёлочь) 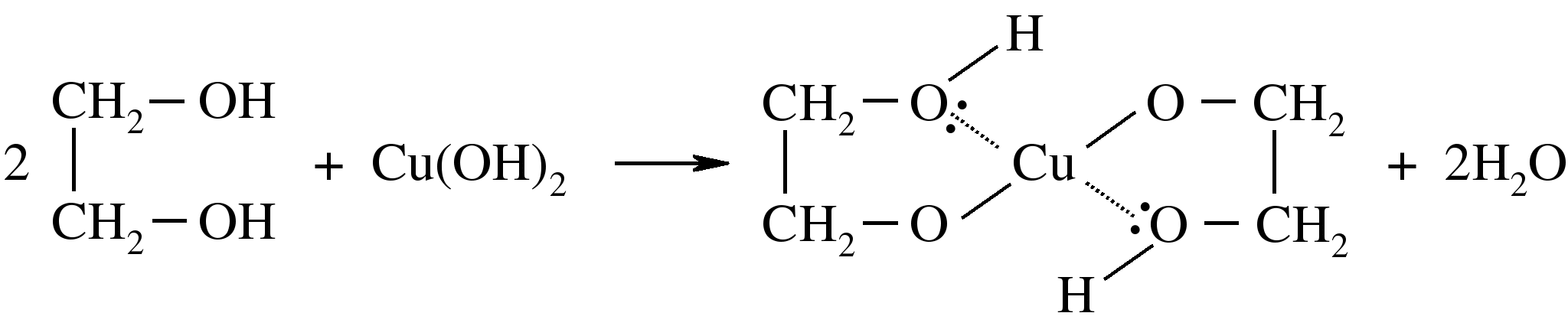
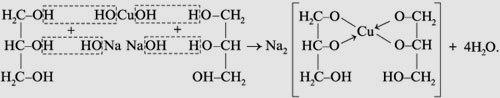
3 группа- глицерин (сульфат меди и щёлочь)
Ученики объясняют свои наблюдения.
Учитель: Проведем ещё химический эксперимент “влияния этанола на молекулы белков”, постараемся найти причины этого явления. Учащиеся проводят опыт, в ходе которого в три пробирки, содержащие куриный белок, добавляют в первую воду, во вторую этиловый спирт, в третью глицерин. Наблюдают: во второй пробирке свёртывание денатурации белка.
Учитель- Дезинфицирующие свойства фенола основаны на его способности свертывать белок (прекращается жизнь бактерий). Этим же свойством обусловливается появление белых пятен на коже рук при неосторожном обращении.
Каждая группа результаты исследования записывает по схеме: цель – выводы – аргументы.
Ученик: В ходе эксперимента мы убедились, что под влиянием этилового спирта, даже незначительных доз его, каждая клетка, каждый орган, соприкасаясь с его молекулами, испытывает на себе токсическое воздействие.
Учитель: Молодцы! Потрудились хорошо. Теперь посмотрим, как вы закрепили знания.
7 слайд Проверочное тестирование (5 минут)

Ответы проверяются .
Наиболее сильным ученикам предлагается индивидуальная работа, задания по теме из части С ЕГЭ. 1. Напишите уравнения реакций, с помощью которых можно осуществить превращения и укажите условия их проведения:
+H2O +HCl +H2O t°C



 бутен-1 X1 X2 X3 X4
бутен-1 X1 X2 X3 X4
H2SO4 H2SO4 H2SO4 H2SO4
2. Какую молекулярную формулу имеет одноатомный спирт, при взаимодействии 14,8 г которого с металлическим натрием выделяется 2,24 л водорода.
8 слайд Учитель--Где же применяются спирты? Ответы учащихся




Применение Ученые определили , что в ягодах винограда содержится большое количество фенолов. Именно благодаря фенолам вино обретает не только свой характерный привкус, но и многие целебные свойства, позволяющие защитить наш организм от многих болезней и инфекций.
Помимо этого польза красного вина так же обусловлена и сильным анти-окислительным действием, которое играет весьма значимую роль для профилактики атеросклероза и других болезней сердечно - сосудистой системы. Уникальный состав вина во многом благотворно воздействует на стенки сосудов, препятствуя образованию тромбов. Фенолы, входящих в состав вина, так же защищают клеточные оболочки не только сосудов, но и головного мозга.
Полифенолы – вот истинная ценность винограда
Они содержатся не только в ягодах,
но даже в виноградных косточках.
V этап: Подведение итогов.

Выводы делаются совместно с учащимися, как повторение основополагающих моментов урока.
Заключение Мы сегодня хорошо потрудились.
«Знать хорошее важнее, чем знать многое»
Ж.Ж. Руссо
Домашнее задание: повторить спирты.
Для подготовки к ЕГЭ задание уровня С5, для углублённого изучения химии
Учителем проверяется индивидуальная работа учащихся. При наличии времени на уроке можно записать решение на доске. Основная подготовка по заданиям части С организуется учителем на консультации.
Некоторая предельная карбоновая одноосновная кислота массой 6 г требует для полной этерификации такой же массы спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты
VI этап: Подведение итогов.
Учащиеся подсчитывают сумму баллов, набранных ими в ходе урока. И выставляют оценку
12 баллов «5»
10 -11 балов «4»
7 -9 баллов «3»
Группа №2
Вспомните правила техники безопасности! 
Инструкция №1
Возьмите небольшое количество этиленгликоля, и проверти его на индикатор. Объясните, что вы наблюдаете.
Инструкция №2
Получите оксид меди (2) , прокаливая медную проволоку
( осторожно) в верхней части пламени спиртовки.
Раскалённую докрасна проволоку внесите в пробирку с этиловым спиртом. Проделайте несколько раз. Что вы наблюдаете? Запах, какого вещества ощущаете?
Инструкция №3
Качественная реакция на многоатомные спирты.
В пробирку с гидроксидом натрия прилить раствор сульфата меди , затем по каплям прилить раствор этиленгликоль. Сделайте вывод.
Инструкция №4
Небольшое количество раствора белка, добавьте в пробирку с водой и в пробирку с этиленгликолем. Объясните свои наблюдения.
Группа №3

Вспомните правила техники безопасности!
Инструкция №1
Возьмите небольшое количество глицерина, и проверти его на индикатор. Объясните результат.
Инструкция №2
Получите оксид меди (2) , прокаливая медную проволоку
( осторожно) в верхней части пламени спиртовки.
Раскалённую докрасна проволоку внесите в пробирку с этиловым спиртом. Проделайте несколько раз. Что вы наблюдаете? Запах, какого вещества ощущаете?
Инструкция №3
Качественная реакция на многоатомные спирты.
В пробирку с гидроксидом натрия прилить раствор сульфата меди , затем по каплям прилить раствор глицерина. Сделайте вывод.
Инструкция №4
Небольшое количество раствора белка, добавьте в пробирку с водой и в пробирку с глицерин. Объясните свои наблюдения.
10


































