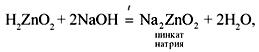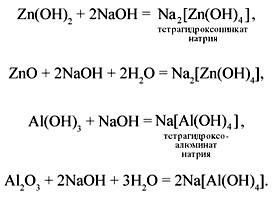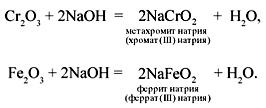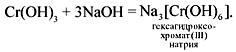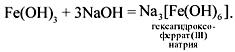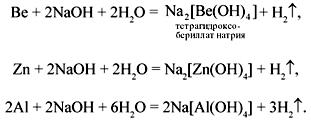Образование и разрушение комплексных солей на примере
гидроксокомплексов.
Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они нерастворимы в воде, но взаимодействуют и с кислотами, и со щелочами. При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений цинка, бериллия, алюминия, железа и хрома. Рассмотрим эти свойства с точки зрения амфотерности.
1 Основные свойства при взаимодействии с сильными кислотами. Например,
ZnO + 2HCl = ZnCl2 + H2O,
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Al2O3 + 6HCl = 2AlCl3 + 3H2O,
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
2 Кислотные свойства при взаимодействии со щелочами.
1) Реакции при сплавлении:
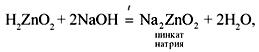
Формулу гидроксида цинка записывают в кислотной форме – H2ZnO2 (цинковая кислота). Кислотная форма гидроксида алюминия – H3AlO3 (ортоалюминиевая кислота), но она неустойчива, и при нагревании отщепляется вода:
H3AlO3  H2O + HAlO2,
H2O + HAlO2,
получается метаалюминиевая кислота. По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты:
Al(OH)3 + NaOH  NaAlO2 + 2H2O,
NaAlO2 + 2H2O,
Al2O3 + 2NaOH  2NaAlO2 + H2O.
2NaAlO2 + H2O.
2) Реакции в растворе происходят с образованием комплексных солей:
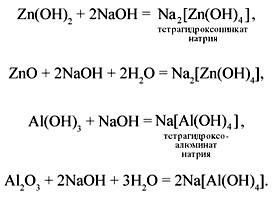
Следует отметить, что при взаимодействии соединений алюминия со щелочами в растворе получаются разные формы комплексных солей:
Na3[Al(OH)6] – гексагидроксоалюминат натрия;
Na[Al(H2O)2(OH)4] – тетрагидроксодиакваалюминат натрия.
Форма соли зависит от концентрации щелочи.
Соединения бериллия (ВеО и Ве(ОН)2) взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома(III) и железа(III) (Cr2O3, Cr(OH)3, Fe2O3, Fe(OH)3) – аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют со щелочами только при сплавлении.
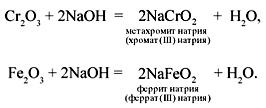
При взаимодействии гидроксидов этих металлов со щелочами в растворе получаются комплексные соли с координационным числом 6.
Гидроксид хрома(III) легко растворяется в щелочах:
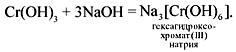
Гидроксид железа(III) имеет очень слабые амфотерные свойства, взаимодействует только с горячими концентрированными растворами щелочей:
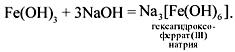
3 Металлические бериллий, цинк и алюминий взаимодействуют с растворами щелочей, вытесняя из них водород:
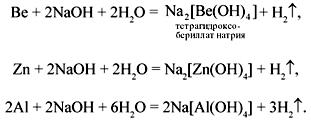
Железо и хром с растворами щелочей не реагируют, образование солей возможно только при сплавлении с твердыми щелочами.
4 При рассмотрении способов разрушения гидроксокомплексов можно выделить несколько случаев.
1) При действии избытка сильной кислоты получаются две средних соли и вода:
Na[Al(OH)4] + 4HCl (изб.) = NaCl + AlCl3 + 4H2O,
K3[Cr(OH)6] + 6HNO3 (изб.) = 3KNO3 + Cr(NO3)3 + 6H2O.
2) При действии сильной кислоты (в недостатке) получаются средняя соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
+ H2O,
K3[Cr(OH)6] + 3HNO3 = 3KNO3 + Cr(OH)3 + 3H2O.
+ 3H2O.
3) При действии слабой кислоты получаются кислая соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
+ H2O,
4) При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 ,
,
K3[Cr(OH)6]+ 3SO2 = 3KHSO3 + Cr(OH)3 .
.
5) При действии солей, образованных сильными кислотами и катионами Fe3+, Al3+ и Cr3+, происходит взаимное усиление гидролиза, получаются два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3 + Fe(OH)3
+ Fe(OH)3 + 3NaCl,
+ 3NaCl,
K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3 + Cr(OH)3
+ Cr(OH)3 + 3KNO3.
+ 3KNO3.
6) При нагревании гидроксокомплексов щелочных металлов выделяется вода:
Na[Al(OH)4]  NaAlO2 + 2H2O
NaAlO2 + 2H2O ,
,
K3[Cr(OH)6]  KCrO2 + 2H2O
KCrO2 + 2H2O + 2KOH.
+ 2KOH.