
Тема урока:
Окислительно -восстановительные реакции

Признак классификации химической реакции
- По числу и составу реагирующих и образующихся веществ
- По агрегатному состоянию веществ
- По направлению
- По использованию катализатора
- По тепловому эффекту
- ???
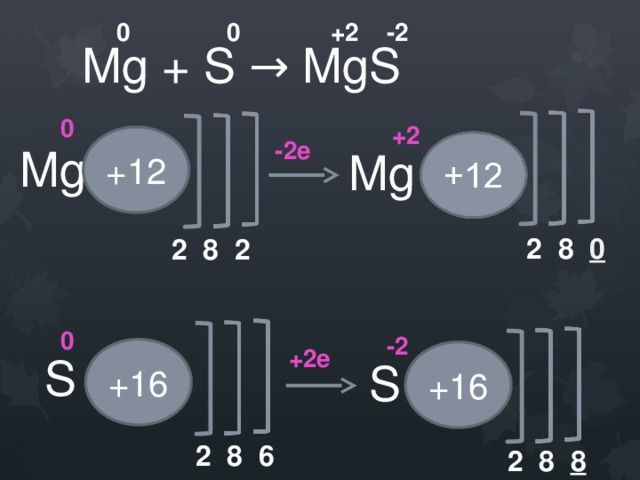
0 0 +2 -2
Mg + S → MgS
0
+2
+12
-2е
Mg
Mg
2 8 0
2 8 2
0
-2
+2е
+16
+16
S
S
2 8 6
2 8 8

Отдает электроны
Принимают электроны
Восстановитель
Окислитель
Повышают степень окисления
Понижают степень окисления
0 -2
0 +2
Mg + S → MgS
Mg + S → MgS

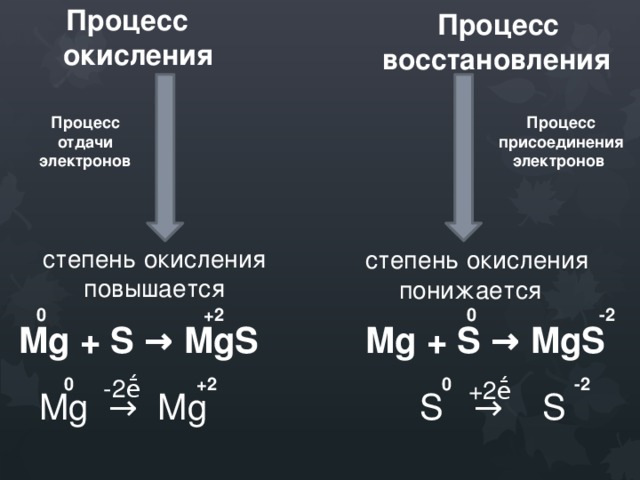
Процесс
окисления
Процесс восстановления
Процесс отдачи электронов
Процесс присоединения электронов
степень окисления повышается
степень окисления понижается
0 +2
0 -2
Mg + S → MgS
Mg + S → MgS
-2ḗ
0 +2
0 -2
+2ḗ
Mg → Mg
S → S

ОВР – это реакции, в которых происходит изменение степени окисления.
0 0 +2 -2
Mg + S → MgS
0 +2
-2ḗ
Mg → Mg
Восстановитель , процесс окисления
0 -2
+2ḗ
S → S
Окислитель, процесс восстановления

Метод электронного баланса как способ составления уравнений ОВР
H 2 + O 2 → H 2 O
H 2 ° -2e → 2H + 4 2 восстановитель, процесс окисления
O 2 ° +4e → 2O - ² 2 1 окислитель, процесс восстановления
Н 2 – восстановитель, О 2 - окислитель
2H 2 + O 2 → 2H 2 O.
Алгоритм составления химических уравнений методом электронного баланса:
1.Составить схему реакции.
2.Определить степени окисления элементов в реагентах и продуктах реакции.
3.Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
4.Подчеркнуть элементы, степени окисления которых изменяются.
5.Составить электронные уравнения процессов окисления и восстановления.
6.Определить, какой элемент окисляется (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается) в процессе реакции.
7.В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
8.Определить восстановитель и окислитель.
9.Сбалансировать число электронов между окислителем и восстановителем.
10.Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
11.Записать коэффициент перед формулой вещества, определяющего среду раствора.
12.Проверить уравнение реакции.

Помните!
Степень окисления простых веществ равна 0;
Степень окисления металлов в соединениях равна номеру группы этих металлов (для I-III группы).
Степень окисления атома кислорода в соединениях обычно равна - 2, кроме H 2 O 2 -1 и ОF 2.
Степень окисления атома водорода в соединениях обычно равна +1, кроме МеH (гидриды).
Алгебраическая сумма степеней окисления элементов в соединениях равна 0.

Задание № 1
I вариант
К окислительно-
восстановительным
реакциям не относится
реакция, представленная
схемой:
А) N 2 + 3Н 2 = 2NН 3
Б) Mg + 2HCl = MgCl 2 + + H 2 ↑
В)MgCO 3 = MgO + CO 2 ↑
Г) 2CuO = 2Cu + O 2 ↑
II вариант
К окислительно-
восстановительным
реакциям относится
реакция, представленная
схемой:
А) H 2 O + CaO = Ca(OH) 2
Б) H 2 O + N 2 O 5 = 2HNO 3
В) Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
Г) CuO + H 2 = Cu + H 2 O

Задание № 2
I вариант
В каком соединении
степени окисления
элементов равны -3 и +1
А) NF 3 Б) Cl 2 O 3
В) NH 3 Г) AlCl 3
II вариант
В каком соединении
степени окисления
элементов равны +3 и -2
А) NF 3 Б) Cl 2 O 3
В) NH 3 Г) AlCl 3

Задание №3
I вариант
II вариант
Схема Na 0 → Na +1
Схема Сl 0 → Сl -1
отражает процесс:
отражает процесс:
А) Окисления
А) Окисления
Б) Восстановления
Б) Восстановления
В) Нейтрализации
В) Нейтрализации
Г) Диссоциации
Г) Диссоциации

§ 43, упр. 2,5
Домашнее задание




























