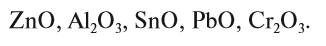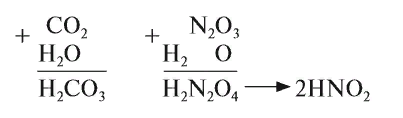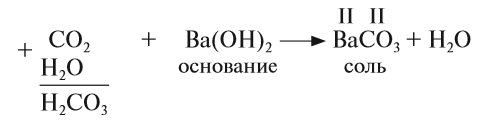Оксиды
По формуле оксида можно определить, какими свойствами он обладает, можно предсказать, возможна ли эта реакция или нет! Но КАК это сделать? Вот некоторые правила:
неметаллы образуют только кислотные оксиды*;
металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
* Обратите внимание, что и несолеобразующие оксиды образуются только неметаллами.
Предсказать свойства оксида металла может помочь эта схема.
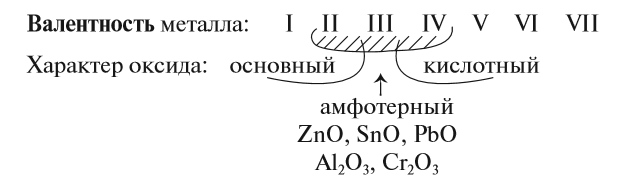 Итак, основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Но как быть с амфотерными оксидами? «Любимая» валентность металлов в этих оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов:
Итак, основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Но как быть с амфотерными оксидами? «Любимая» валентность металлов в этих оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов:
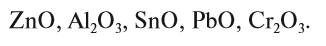
Свойства кислотных оксидов
1. Кислотные оксиды, кроме SiО2, реагируют c водой, образуя кислоту:

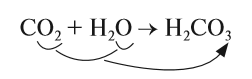
Чтобы составить формулу кислоты, нужно «сложить» все атомы исходных веществ, записывая на первом месте символ водорода, на втором — символ элемента, образующего оксид, и на последнем — символ кислорода. Если индексы получились чётными, их можно сократить:
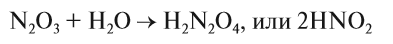
Эти же реакции можно записать в виде «арифметического примера»:

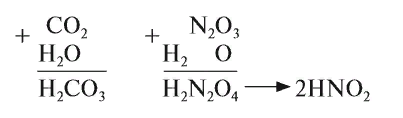
Задание 2.6. Составьте уравнения реакций с водой для кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + вода → кислота
2. Кислотные оксиды реагируют с основными оксидами, образуя соль соответствующей кислоты, т. е. кислоты, которая образуется при взаимодействии этого оксида с водой (см. выше):

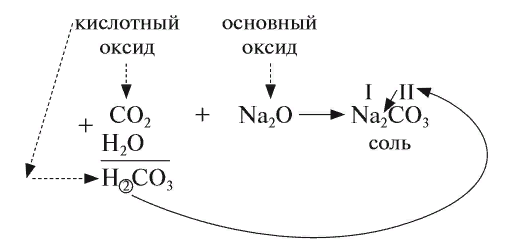
Для того чтобы составить такое уравнение, нужно:
составить формулу кислоты («прибавив» к молекуле оксида молекулу воды);
определить валентность кислотного остатка (это часть молекулы кислоты без атомов водорода). В данном случае кислотный остаток имеет состав СО3, его валентность равна числу атомов водорода в кислоте, т. е. II;
составить формулу соли, записав вместо атомов водорода атом металла из основного оксида с его валентностью (в данном случае — натрий);
составить формулу соли по валентности металла и кислотного остатка.
Задание 2.7. Составьте уравнения реакций с оксидом кальция кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + основный оксид → соль
3. Кислотные оксиды реагируют с основаниями, образуя соль соответствующей кислоты и воду:
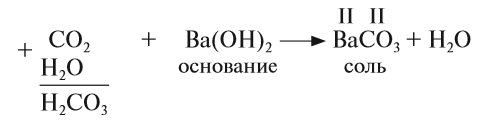
Принципы составления уравнения те же, что и для реакций с основными оксидами (см. пункт 2).
Задание 2.8. Составьте уравнения реакций с гидроксидом натрия NаОН кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + основание → соль + вода
ЗАПОМНИТЕ! Кислотные оксиды и с кислотами и кислотными оксидами НЕ РЕАГИРУЮТ!







 Итак, основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Но как быть с амфотерными оксидами? «Любимая» валентность металлов в этих оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов:
Итак, основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Но как быть с амфотерными оксидами? «Любимая» валентность металлов в этих оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов: