Решения
10 -1.
1. BaH2 + 2Br2 = BaBr2 + HBr
2. Fe2O3 + Na2CO3 = 2NaFeO2 + CO2
3. 2Cr(OH)2 +H2O2 = 2Cr(OH)3
Cистема оценивания:
1. За уравнение 1 - 4 балла
2. За уравнения 2, 3 - по 3 балла.
Итого: 10 баллов.
10-2.
В ходе выполнения анализа протекают следующие реакции
H2S + Cd(CH3COO)2 + 2CH3COOH = CdS↓ + 2CH3COOH;
CdS + I2 = 2CdI + S↓;
I2 + 2Na2S2O3 = 2NaI + Na2S2O6
Количество вещества добавленного йода составило

На титрование избытка йода потребовалось
 ,
,
что соответствует 0,00064 моль йода.
количество вещества йода вступившего в реакцию составляет
0,0016 – 0,00128 = 0,00032 моль.
n(I2) = n(H2S) = 0,00032 моль.
 =0,00032моль·22,4л/моль = 0,007168 л
=0,00032моль·22,4л/моль = 0,007168 л (при н.у.)
(при н.у.)
Приведем объем сероводорода к условиям эксперимента

 (л)
(л)

m(H2S) = n·M=0,00032 моль·34 г/моль=0,01088 г
Концентрация H2S в пробе составила
0,01088г/0,00268 м3 = 4,06 г/м3 = 4060 мг/м3, что во много раз превышает предельно допустимую концентрацию 10 мг/м3.
Система оценивания:
1. За каждое из 3 уравнений - по 1 баллу,
2. За расчет объема сероводорода - 3 балла,
3. За расчет объемной доли сероводорода - 3 балла,
4. За расчет концентрации сероводорода в пробе - 1 балл.
Итого: 10 баллов.
10-3.
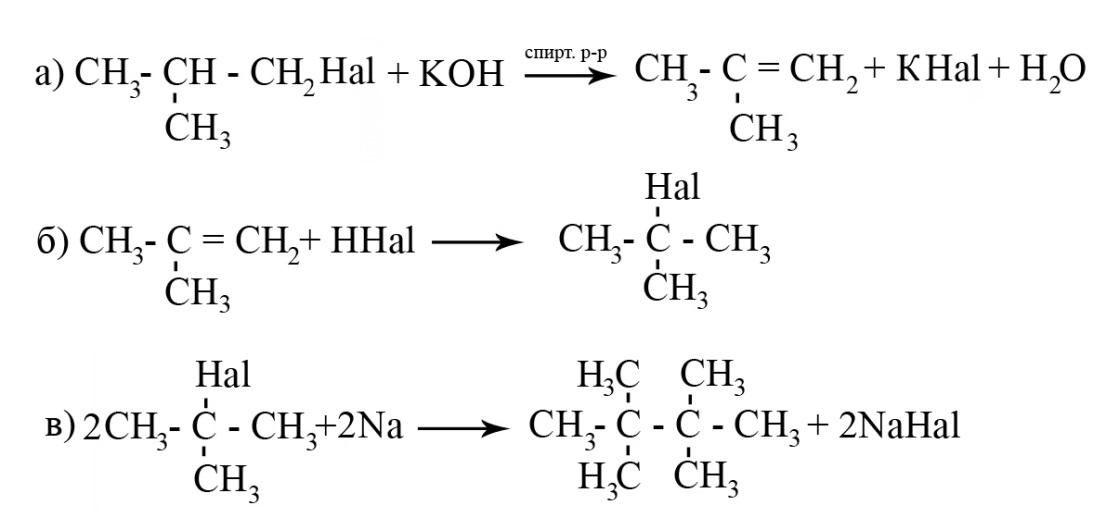
Система оценивания:
за уравнения а) и б) - по 3 балла;
за уравнение в) — 4 балла.
Итого: 10 баллов
10 -4.
Напишем уравнение горения любого углеводорода:
CnH2m +  O2
O2  nCO2 + mH2O
nCO2 + mH2O
Из 1 моль углеводородов образуется 1 моль CO2
2) Исходя из соотношения образовавшегося объема CO2 к объему смеси углеводородов, найдем число атомов углерода в соединении:
n = 36/18 = 2
3) Найдем состав смеси и напишем уравнения горения.
Существует всего 3 углеводорода с двумя атомами углерода: этан, этен, этин.
С2Н2 не входит, так как реакция с [Ag(NH3)2]OH не идет.
Пусть 18 см3 смеси содержит х см3 С2Н6 и у см3 С2Н4, тогда
х + у = 18
C2H6 + 7/2 O2  2CO2 + 3H2O
2CO2 + 3H2O
C2H4 + 3O2  2CO2 + 2H2O
2CO2 + 2H2O
4) Выразим массу воды через 
 =
=  = 0,0362
= 0,0362
5) Решаем систему уравнений
 , откуда х = у = 9.
, откуда х = у = 9.
6) Находим объемные доли компонентов в газовой смеси
φ(С2Н6) = φ(С2Н4) = 9/18 = 0,5 (или 50%)
Ответ: φ(С2Н6) = φ(С2Н4) = 50%.
Cистема оценивания:
за написание уравнения горения любого углеводорода - 2 балла;
за нахождение числа атомов углерода - 1 балл;
за нахождение состава смеси и написание уравнения горения - 4 балла;
за выражение массы воды через  - 1 балл;
- 1 балл;
за решение системы уравнений - 1 балл;
за нахождение объемных долей компонентов в газовой смеси - 1 балл.
Итого: 10 баллов
10-5.
Первый газ – водород:
Zn +2HCl = ZnCl2 + H2. (1)
По уравнению реакции (1): n(Zn) = n(H2);
По условию задачи:  .
.
Второй газ – кислород:
2NaNO3 = 2NaNO2 +O2. (2)
По уравнению реакции (2): n(O2) = 0,5n(NaNO3);
По условию задачи: 

Третий газ – хлор:
MnO2 + 4HCl = MnCl2 + Cl2 +2H2O. (3)
По уравнению реакции (3): n(Cl2) = n(MnO2);
По условию задачи: 

В результате взрыва смеси газов образуются вода и хлороводород:
2H2 = O2 = 2H2O (4);
H2 = Cl2 =2HCl (5).
По уравнению (4) n(H2O)= 2n(O2) = 0,3 моль; m(H2O)= n⋅M = 0,3моль⋅18г/моль = 5,4 г.
При этом прореагировало n4(H2) = 0,3 моль.
По уравнению (5) n(HCl )= 2n(Cl2) = 0,06 моль; m(HCl)= n⋅M = 0,06моль⋅36,5г/моль = 2,19 г.
При этом прореагировало n5(H2) = 0,03 моль.
Следовательно, все исходные газы прореагировали полностью.
В образовавшемся растворе  .
.
Система оценивания.
За уравнения 1,2, - по 1 баллу
За уравнение 3 - 2 балла
За уравнения 4,5 - по 0,5 балла
За расчет количества вещества каждого газа по уравнениям 1-3 - по 1 баллу
За расчет по уравнениям 4,5 - по 1 баллу
За расчет массовой доли - 1 балл.
Итого: 10 баллов







 ,
, =0,00032моль·22,4л/моль = 0,007168 л
=0,00032моль·22,4л/моль = 0,007168 л (при н.у.)
(при н.у.)
 (л)
(л)

 , откуда х = у = 9.
, откуда х = у = 9. .
.



 .
.









