Муниципальное бюджетное общеобразовательное учреждение
«Основная общеобразовательная школа №2 станицы Кардоникской»
Региональный этап Всероссийский конкурс юных исследователей окружающей среды «Открытия 2030».
Номинация: «Экологический мониторинг»
Тема учебно-исследовательской работы:
«Определение pH почвенной вытяжки и оценка кислотности почвы»
|
|
Автор: Каитова Айшат Алиевна, ученица 9 класса МБОУ «ООШ № 2 ст. Кардоникской» |
|
| Руководитель: Абайханова Алима Азрет-Алиевна, учитель биологии и химии МБОУ «ООШ № 2 ст. Кардоникской»
|
ст. Кардоникская
2024
Содержание
| Введение ……………………………………………………………3 |
|
| 1. Теоретическая часть………………………………………………4 |
|
| 1.1 Общая характеристика исследуемого объекта……………….4 |
|
| 1.2 Реакция почвы…………………………………………………4 1.3 Почему важна кислотность почвы……………………………6 1.4 Буферная способность почв ………………………………..…8 1.5 Причины подкисления почвы .....................................................8 1.6 Кислотность грунта, фитоценозы и растения-индикаторы…..10 |
|
| 2. Экспериментальная часть………………………………………..13 |
|
| 2.1 Определение pH дистиллированной воды …………………13 |
|
| 2.2 Определение кислотности почвы …………… …………….14 |
|
| Заключение…………………………………………………………15 |
|
| Список литературы…………………………………………………16 |
|
Приложение……………………………………………………17-21
Введение.
Земля — ценнейшее природное достояние народа, место обитания человека. Почвенный покров является объектом труда и средством производства. Он используется для выращивания растений, получения биологической массы разного рода продукции, размещения населенных пунктов, промышленных предприятий, дорог, аэродромов, мест отдыха.
Почва – это рыхлый поверхностный слой земли. Он включает в себя твердые, жидкие, газообразные компоненты и формируется в результате сложного взаимодействия климата, растений, животных, микроорганизмов. Поэтому во многом плодородие почвы обуславливается ее определенными физико-химическими свойствами. Рассмотрим один из показателей оценки качества почвы–уровень ее кислотности.
Выбранная нами тема актуальна, так как от этой самой кислотности почвы зависит и ее плодородие, и способность растений противостоять болезням, и количество полученного урожая с этой почвы.
Практическая значимость исследования заключается в том, что полученные результаты дадут возможность определять кислотность почвы на пришкольном участке, что поможет с выбором культуры и повысить урожайность.
Объект: пробы почвы из пришкольного участка.
Предмет исследования: кислотность почвы.
Цель: Определить кислотность почв на пришкольном участке (то есть измерить показатель рН водной вытяжки почвы) при помощи цифровой лаборатории Архимед(Приложение 1.).
Для достижения поставленной цели нами были решены следующие задачи: - изучить информационные материалы по теме исследования; - освоить методику приготовления почвенной вытяжки; - определить pH в лабораторных условиях; - сделать выводы о кислотности почвы.
Благополучие окружающей среды во многом зависит от санитарного состояния почвы. Чистая, здоровая почва — залог чистоты окружающей среды, экологически безопасных продуктов, а значит, и здоровья человека.
Без сохранения почвенного покрова окажется невозможным и сохранение исторически сложившегося круговорота веществ в природе. Поэтому каждому человеку полезно иметь представление о состоянии почвенного покрова в том месте, где он живет.
А для человека, живущего в сельской местности, чья жизнь непосредственно зависит от количества собранного урожая, проблема снижения плодородия почвы - одна из самых важных задач.
Теоретическая часть
1.1. Общая характеристика исследуемого объекта.
В качестве объекта для исследования почвы нами был выбран учебно-опытный участок МБОУ « СОШ №1 ст. Кардоникской». Учебно-опытный участок находиться на территории школы. Вблизи от пришкольного участка нет промышленных и сельскохозяйственных предприятий, но близко располагается автомобильная трасса. На территории школы и в окрестностях нет источников поверхностных вод (родников, рек, болота и др.). Учебно-опытный участок школы не большой, в котором организован отдел цветочно-декоративных культур. В данном отделе выращиваются однолетние, двулетние и многолетние цветочно-декоративные растения.
1.2 Реакция почвы. На рост и развитие растений и микроорганизмов сильное влияние оказывает такая чисто химическая характеристика почвы, как кислотность. Кислотность почвы – это, по сути, количество в ней органических и неорганических кислот, а также других веществ, проявляющих кислотные свойства. Измеряют ее в единицах рН (водородный показатель), ведь концентрация ионов водорода пропорциональна количеству кислот в среде. Показатель pH ввел датский химик Сорен Петр Лауриц Соренсен (1868-1939). Водородный показатель определяется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+]
рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Принято измерять уровень pH по 14-цифровой шкале. Кислая среда: [H+] [OH-]
Нейтральная среда: [H+] = [OH-]
Щелочная среда: [OH-] [H+] Почвы бывают кислые, нейтральные и щелочные. В природе разные почвы имеют и разную реакцию: например, болотные и подзолистые почвы, а также краснозёмы отличаются кислотностью, солонцы -щёлочностью, а чернозёмы - средней реакцией. Нейтральный грунт имеет значение в интервале 6-7, слабокислый – 5, а слабощелочной – примерно 8. Показатель среды кислой почвы будет примерно 4-5, а щелочной 9-10. (приложение 2). Реакция почвы в сильнейшей степени зависит от того, какие вещества поглощены почвой. Если почва (твёрдая её часть) поглотила алюминий или водород, она будет кислой; почва, забравшая из раствора натрий, будет щелочной, а почва, насыщенная кальцием, будет иметь нейтральную, то есть среднюю реакцию. Водород содержится в воде и в различных кислотах. Кроме того, водород в почвенный раствор выделяют, по-видимому, корни живых растений. Кальций содержится в извести, в гипсе и в других солях, алюминия много в глине и других минералах. Очень немногие культуры (например, чайный куст, некоторые овощные культуры) хорошо развиваются в условиях кислой реакции среды. Большая же часть сельскохозяйственных культур, в том числе пшеница, овес, кукуруза, сахарная свекла, подсолнечник, люцерна, многолетние травы и другие, а также плодовые деревья и кустарники, дают наиболее высокие урожаи в условиях слабокислой или нейтральной реакции среды, т.е. в интервале значений рН от 6 до 7. Кислотность почв делится на актуальную и потенциальную. Актуальная кислотность–это кислотность почвенного раствора, обусловленная повы-шенной концентрацией в нем ионов Н+, а также слабых минеральных (Н2СОз), органических кислот и гидролитически кислых солей (А1С1з). Актуальная кислотность непосредственно влияет на развитие растений и почвенных микроорганизмов. Классификация почв по уровням актуальной кислотности
| Почвы | pH |
| Сильнокислые | 3-4 |
| Кислые | 4-5 |
| Слабокислые | 5-6 |
| Нейтральные | 7 |
| Слабощелочные | 7-8 |
| Щелочные | 8-9 |
| Сильнощелочные | 9-11 |
Потенциальная (скрытая) кислотность обусловлена ионами Н +,Al3+и Fe3+, поглощёнными ППК с отрицательным зарядом, связанная с твердыми фазами почвы. ППК - почвенный поглощающий комплекс - совокупность минеральных, органических и органоминеральных соединений высокой степени дисперсности, нерастворимых в воде и способных к обменным реакциям.
1.3 Почему важна кислотность почвы.
Хотя отдельные виды растений приспособились к существованию в кислой или наоборот в щелочной среде, однако большинство растений хорошо развиваются при нейтральной или слабокислой реакции почвы (диапазон pH 6,0-7,0). Это не ведет к недостатку фосфора и микроэлементов, большинство основных питательных веществ доступны растениям, т.е. находится в почвенном растворе. Такая почвенная реакция благоприятна для развития полезных почвенных микроорганизмов, обогащающих почву азотом.
При низких значениях рН заметно снижается активность многих микроорганизмов, в результате чего замедляется разложение растительных остатков и освобождение из них азота, фосфора, серы и многих микроэлементов.
В условиях кислой реакции концентрация ряда химических элементов, прежде всего Al3+ и Mn2+ , может достигать уровня, токсичного для многих растений. Повышенная концентрация Al3+ препятствует правильному развитию корневых систем, особенно в фазе проростков, угнетает реакцию фосфорилирования, снижает поступление в растения Ca 2+, Mg 2+, K +, P, ионов железа, тормозит реакции репликации нуклеиновых кислот вследствие образования прочных комплексов Al3+ с этими кислотами, уменьшает потребление воды растениями.
Под влиянием высокой концентрации Al3+ ухудшается качество растительной продукции – снижается содержание крахмала в картофеле, сахара в сахарной свекле, белка в бобовых культурах, подавляется образование хлорофилла. В целом в растительной продукции уменьшается содержание моносахаридов, сахарозы и суммы сахаров, а также белковых форм азота. Негативное влияние Al3+ на растения особенно сильно проявляется на первых
стадиях их развития и при общем недостатке элементов питания.
Чрезмерный высокий (выше 9) или низкий (ниже 4) pH почвы токсичен для корней растений. В пределах этих значений pH определяет поведение отдельных питательных веществ, осаждение их или превращение в неусваиваемые растениями формы.
На кислой почве может наблюдаться повышенный выпад растений без внешних причин - вымочка, гибель от мороза, развитие болезней и вредителей.
Напротив, в щелочных (pH 7,5-8,5) железо, марганец, фосфор, медь, цинк, бор и большинства микроэлементов становятся менее доступными растениям.
Следует учитывать, что многие из овощей - салат, капуста кочанная и цветная, свекла, огурцы, лук, спаржа, а также клевер и люцерна - при pH=6.0 и ниже развиваются хуже, чем при реакции близкой к нейтральной. Такую же кислотность предпочитает большинство цветов. В почвах с повышенной кислотностью подавляется жизнедеятельность многих полезных организмов — аммонифицирующих и нитрифицирующих микробов, азотобактерий, бактерий, разрушающих фосфорорганические соединения и т.д.
Кислые почвы отличаются и неблагоприятными физическими свойствами. При недостатке кальция, образующего нерастворимые гуматы, гумусовые вещества хуже закрепляются в почве и выносятся из нее нисходящими токами воды, отчего не только уменьшается запас питательных элементов, но и ухудшается структура почвы. Бесструктурность кислых почв при их избыточном увлажнении приводит к недостатку воздуха и развитию анаэробных процессов.
1.4 Буферная способность почв.
Непрерывное образование водородных ионов H+ происходит при растворении в почвенной воде углекислого газа (CO2) т.е. образования угольной кислоты. Углекислый газ выделяется корнями живых растений при дыхании, а также при распаде органики (органических удобрений) ,образовании НNО3 при нитрификации и от продуктов жизнедеятельности микроорганизмов. H+ могут вытеснять в почвенный раствор минеральные катионы, более того, ионы кальция, магния, калия и натрия, находятся в постоянном движении между почвенными частицами, почвенным раствором и корнями растений. Восполнение кальция, магния, калия и натрия происходит за счет распада минеральных почвенных частиц и внесения органических и минеральных удобрений.
Изменение реакции разных почв под действием этих факторов неодинаково. Способность почвы противостоять изменению реакции почвенного раствора в кислую или щелочную сторону называется буферной способностью почвы.
Буферность почвы в целом зависит от буферных свойств ее твердой и жидкой частей. Буферность раствора создаётся слабыми кислотами и их солями. Чем больше ионов водорода в почве, тем сильнее она будет противостоять подщелачиванию. На почвах с низкой буферной способностью(песчаных, супесчаных, бедных гумусом) при внесении физиологически кислых удобрений возможны резкие сдвиги реакции в кислую сторону. На таких почвах вносят также меньшие дозы извести, чем на суглинистых, так как они слабо противостоят подщелачиванию. Это нужно учитывать при внесении минеральных удобрений и извести.
1.5 Причины подкисления почвы
Кислые почвы формируются в условиях умеренно-холодного климата, где количество осадков превышает величину испаряемости, и имеет место промывной и периодически промывной режим. В этой природной зоне подстилающими породами являются глины и ледниковые отложения, бедные кальцием и магнием. Лесная и таежная растительность образует опад, имеющий кислую реакцию, что также способствует выносу из почв кальция и магния и образованию кислых почв.
Там, где количество осадков превышает 500 мм в год, ежегодные потери кальция из-за вымывания составляют примерно 55 г/кв.метр. Приблизительно такое же количество кальция выносится из почвы с хорошим урожаем.
Углекислый газ, растворенный в почвенной воде, является мощным растворителем соединений кальция, переводя, в частности нерастворимый карбонат кальция CaCО3 в растворимый гидрокарбонат кальция Ca(HCO3)2. При возрастании активности почвенных микроорганизмов в почву выделяется много углекислого газа, что ведет к потерям кальция из-за вымывания его из почвы в виде гидрокарбоната.
Основной особенностью кислых почв является недостаток в них ионов кальция и избыток ионов водорода и алюминия, что обуславливает их крайне неблагоприятные агрохимические свойства.
Прежде всего,Ca— важный элемент питания растений: его недостаток замедляет их развитие, снижает плодоношение, уменьшает зимостойкость. С середины XX века одной из основных причин закисления почв становится хозяйственная деятельность человека. Развитие индустрии привело к выбросам в атмосферу колоссальных количеств оксидов серы, азота, углерода. Эти оксиды переносятся на значительные расстояния, взаимодействуют с атмосферной влагой и превращаются в растворы смесей сернистой, серной, азотной и угольной кислот, которые выпадают в виде «кислых дождей» на почвы, растения, поверхностные воды. Кислые атмосферные осадки с реакцией pH 4,0-3,5 приводят к неблагоприятным изменениям в экосистемах суши и поверхностных вод, особенно в регионах с природно-кислыми почвами. Кроме кислых атмосферных осадков, подкисление почв Нечерноземной зоны России вызывает использование физиологически кислых удобрений, таких как (NH4)2SО4 , NH4NО3 и т.п. Растения используют катионы этих солей, а анионы образуют свободные кислоты. Наиболее опасен в этом отношении сульфат аммония (NH4)2SО4.
Во всех случаях проявления вторичной (антропогенной) кислотности необходимы регулярные научные наблюдения, экологическая и экономическая оценка отрицательного эффекта и рекомендации и применение предупредительных и мелиоративных мероприятий.
1.6 Кислотность грунта, фитоценозы и растения-индикаторы. Растения, которые предпочитают щелочные почвы, называют кальцефилами, а хорошо растущие только на кислых почвах – ацидофилами.
Распределение растений по кислотности почв.
| Почвы | Дикорастущие растения |
| Кислые и среднекислые | Хвощ лесной, Иван-да-марья (марьянник дубравный), горец птичий и щавелелистный, лютик едкий и ползучий, фиалка трехцветная, кислица, подорожник, мята, сушеница, пырей, цикорий корневой, клюква. |
| Сильнокислые | Сфагновый и зеленый мох, голубика, водяника, черника, чина болотная, седмичник, ожига волосистая, щавель кислый |
| Слабокислые | Щучка(из семейства злаковых), ветреница дубравная, калужница болотная, гравилат речной, осока волосовидная, хвощ болотный, кошачья лапка. |
| Нейтральные и слабокислые | Ромашка непахучая и аптечная, манжетка, мать-и-мачеха, клевер луговой и ползучий, осот, донник белый, редька полевая, бодяк огородный, пастушья сумка, ландыш майский, лапчатка гусиная, тысячелистник, таволга вязолистная, земляника, герань лесная. |
| Щелочные и нейтральные | смолёвка белая (дрема), максамосейка, дельфиниум (живокость), горчица полевая, люцерна, вика посевная, тимофеевка луговая, полевица, костер безостый, мятлик луговой. |
| Щелочные | вейгела, дейция, зверобой, красивоплодник, лаванда, магония. |
| Любые | Овсяница овечья, фиалка болотная, вороний глаз, полевица собачья |
Не только растения-индикаторы, «подсказывающие» какова кислотность почвы, но и растительные сообщества (фитоценозы) сами по себе являются показателями рН:
- Болота, заболоченные местности и места, оставшиеся после осушения болот – сильнокислые субстраты с рН 3-4,5;
- Хвойные леса – кислые почвы;
- Смешанные леса – грунт со средним рН (от 4,5 до 6,0);
- Лиственные леса – слабокислые субстраты - рН 5,0 – 6,4;
- Заливные луга с частичным застоем воды - кислые грунты с показателем рН 5,0 – 6,0;
- Остепнённые луга – слабокислые почвы;
- Ценозы со степной растительностью - рН грунта от слабокислой до нейтральной. Необходимо помнить о том, что в разных местах участка почва может иметь разную кислотность, которая год от года меняется, так что нельзя определить её раз и навсегда.
2.Экспериментальная часть
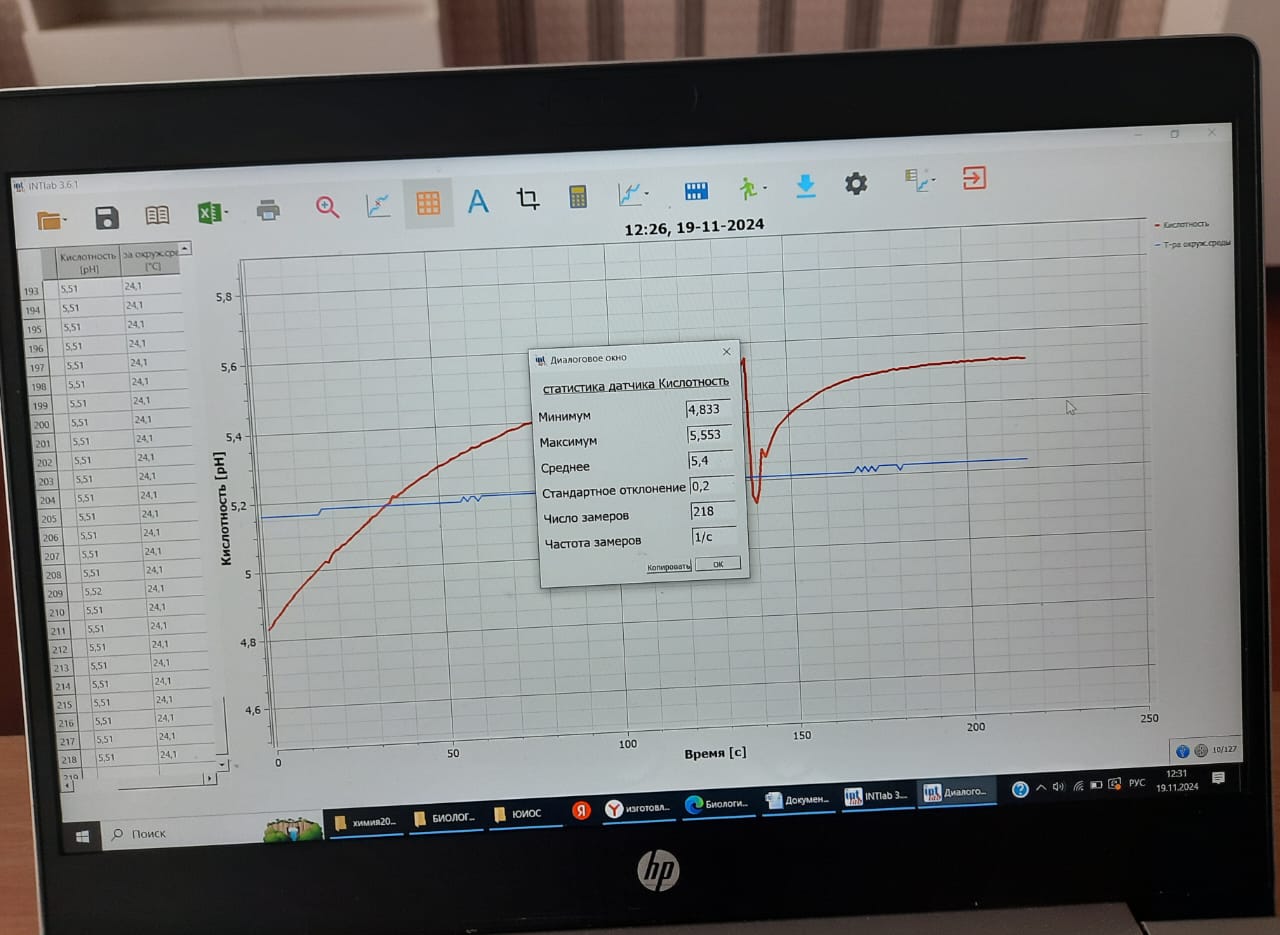
2.1 Определение pH дистиллированной воды.
Абсолютно чистая вода, при температуре 25оС имеет нейтральную реакцию и рН = 7. Если такая вода будет долго стоять в стеклянной посуде, то в результате частичного выщелачивания стекла (процесс ускоряется при кипячении, опыт проделал еще Лавуазье), вода станет слабощелочной. Но если абсолютно чистую воду оставить, даже ненадолго, в контакте с воздухом, то в результате растворения в ней углекислого раза вода станет подкисляться. Причем кислотность будет расти со временем, вплоть до рН 5,5.
Для определения pH нам потребуется:
-Регистратор данных с датчиком pH
-Стеклянные банки (0,5л) для проб почв, (4 шт)
-Банки (0.25л) с дистиллированной водой, (4 шт)
-Грунты (по 50г), 4 пробы
Подключаем pH-метр (диапазон измерений 0–14ед.pH) к измерительному интер-фейсу. Рекомендуемые параметры измерения:
-Частота опроса датчика–каждую секунду
-Количество измерений–1000
Результаты заносим в таблицу.
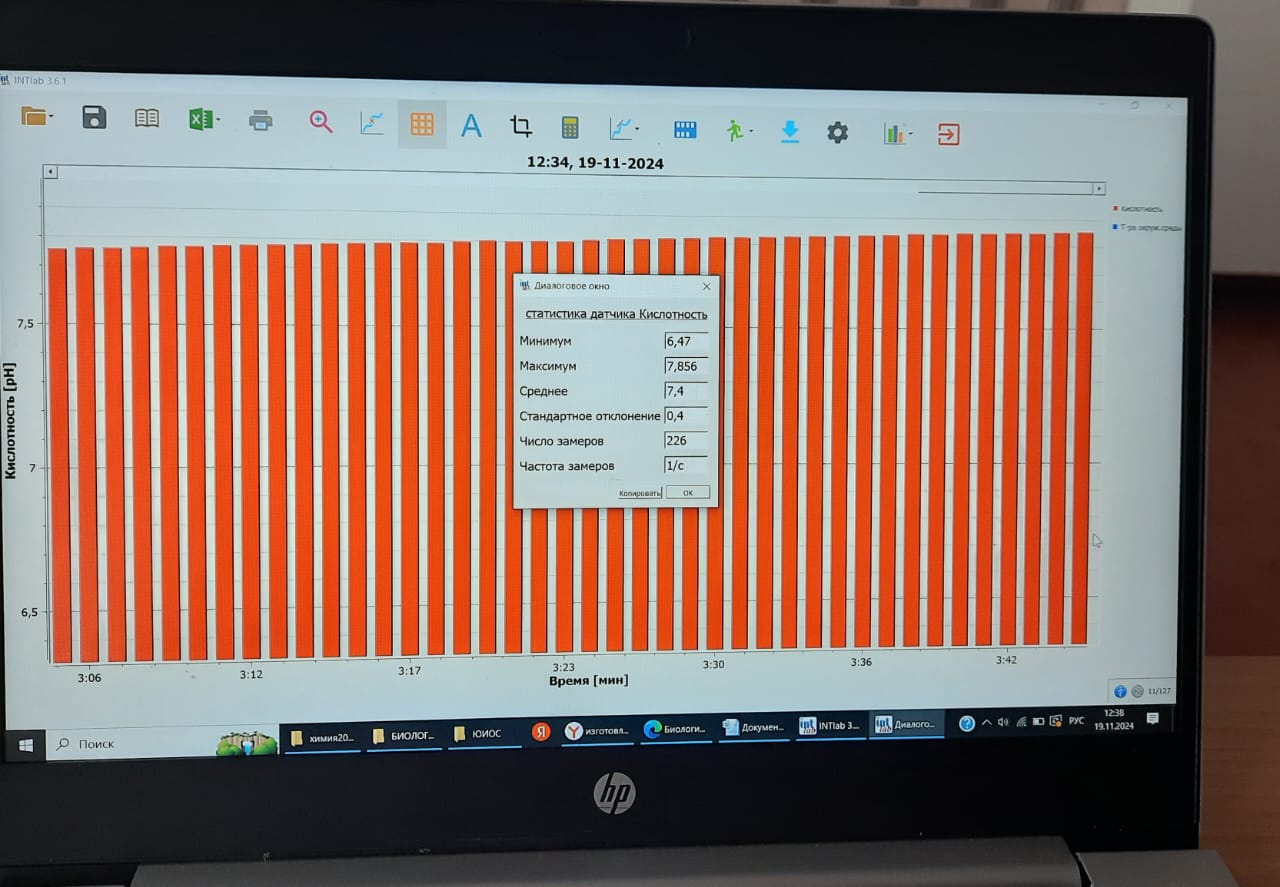
2.2 Определение кислотности почвы.
рН-метр
Наилучший и самый точный метод для определения кислотности субстрата применение рН-метра .Поскольку почва сама по себе твердая и не является раствором, в нее добавляют немного дистиллированной воды для получения достоверных результатов. Почву нужно брать на глубине 3-6 см. Для точного результата нужно сделать не менее 5 проб на расстоянии 20-30 см и
определить среднее значение кислотности. Отбор почвенных образцов лучше проводить в весенний или осенний период. На практике для отбора почвенных образцов часто используют метод конверта. Почву отбирают c глубины 0–10см, на пашне с глубины 0-20 см, в лесу - из лесной подстилки. Для определения pH почвы необходимо приготовить водную вытяжку, которая представляет собой фильтрат водного раствора, полученного после взбалтывания почвы с дистиллированной водой.
В зависимости от целей анализа отношение почвы к воде и время их взаимодействия могут быть разными. Стандартным принято отношение между почвой и дистиллированной водой (лишеннойСО2), равное 1:5, время взбалтывания–3минуты. Затем раствор надо процедить. Далее приступаем к измерению pH данной вытяжки. Результаты заносим в таблицу.
Кислотность почв на пришкольном участке.
| Статистика датчика Кислотность | pH дистиллированной воды ( ед) | pH пробы почвенного образца (ед) | Степень кислотности почвы |
| Минимум | 4,833 | 6,47 | Слабокислая |
| Максимум | 5,553 | 8,097 | Щелочная |
| Среднее | 5,4 | 7,3 | Слабощелочная |
По результатом нашего исследования мы пришли к выводу, что pH дистиллированной воды, в среднем, 5,4 (слабокислая), а pH пробы почвенного образца-7,3 (слабощелочная).
Заключение.
Цель и задачи нашей работы: определить кислотность почвы с помощью цифровой лабораторий Архимед, достигнуты.
Мы проанализировали литературу и другие источники информации по данной теме и сделали вывод, что кислотность почвы играет большую роль в выборе растений на данном участке и получении высокого урожая. Реакция водной вытяжки разных почв колеблется:
- в сфагновых торфах рН в интервале 3–3,5;
- подзолистые и дерново-подзолистые почвы имеют кислую и сильнокислую реакцию, рН составляет 4–5;
- у выщелоченных черноземов и серых лесных почв слабокислая реакция, рН 5,5 - 6,5;
- у обыкновенного и мощного черноземов близкая к нейтральной, рН равно 6,5–7;
-щелочную реакцию имеют южные черноземы и каштановые почвы (рН равно 7,5), сероземы (рНдо8,5) и солонцы (рН до 9 и более).
В результате проведенного исследования мы определили степень кислотности почвы на пришкольном участке
Наиболее точный метод (при помощи лаборатории Архимед) показал нам численное значение рН водной вытяжки пришкольного участка, равное в среднем 7,3. Таким образом, почва на пришкольном участке МБОУ «СОШ № 1 ст. Кардоникской» является слабощелочной.
Результаты моей работы можно использовать на уроках химии, биологии, экологии. Постоянный контроль за кислотностью почв, поддержание реакции почвенной среды в оптимальных параметрах — залог сохранения плодородия почв, получения максимальной отдачи от минеральных удобрений, так как pH влияет на доступность питательных элементов. От того, какая реакция почвы на участке, зависят степень усвоения питательных веществ растениями, их нормальный рост и развитие и, как следствие — формирование будущего урожая.
Список используемой литературы
1.Балаев И.И. «Домашний эксперимент по химии»/ И.И. Балаев – М.: Просвещение, 1977, 127 с.
2.Первое сентября: учебно–методическая газета для учителей химии, №22, 2007 г., 6 с.
3.https://ru.wikipedia.org/wiki/Кислотность_почвы
4. https://en.wikipedia.org/wiki/Soil_pH
5. Биология- лаб-раб Определение кислотности почв на пришкольном участке+cov.pdf
6.https://bigenc.ru/c/agrokhimicheskii-analiz-pochv-7122ea
Приложение 1. Цифровая лаборатория Архимед
Приложение 2. Шкала уровня кислотности

Приложение 3. Отбор пробы почвы с пришкольного участка



Приложение 4. Получение водной вытяжки почвы и определения pH дистиллированной воды и почвенной вытяжки.



Приложение 5.Результаты
.



























