| 2. Введение в тему | Мы с вами приступаем к изучению нового раздела химии. Чтобы догадаться, о чем сегодняшний урок, вы должны продолжить стихотворение, придуманное вашим классным руководителем специально для нашего урока: Как-то утром я проспал.
в школу быстро собирался:
Чал холодный наливал,
Сахар всыпал, помешал,
Но не сладким он остался.
Я ещё досыпал ложку,
Стал послаще он немножко.
Чай допил я до остатка,
А в остатке стало сладко
Сахар ждал меня на дне!
Стал прикидывать в уме –
Отчего судьбы немилость?
Виновата – растворимость. | Тема: Растворение. Растворимость веществ в воде. (записывают в тетрадь) |
| 3. Актуализация знаний | Урок начнем с проверки ваших знаний, юные химики! Я предлагаю всему классу мысленно отправиться в химическое королевство, где мирно и дружно живут (нам уже знакомые) химические элементы. На химическое королевство напал трехглавый дракон. Победить его можно с помощью знаний. Каждый правильный ответ принесет нам победу над одной головой.
Вам надо: Записать уравнение реакции на доске и уравнять. Определить тип реакции, дать определение. Объяснить изменение окраски индикатора. | Проверка знаний. Раствор – это Растворитель – Это вещество, растворяющее какое-л. другое вещество. Кристаллогидрат – это кристаллы, содержащие молекулы воды и образующиеся, если в кристаллической решётке катионы образуют более прочную связь с молекулами воды, чем связь между катионами и анионами в кристалле безводной соли. Взаимодействие натрия с водой. Тип реакции - замещения Лакмус фиолетовый стал синим, т.к. в растворе находится щелочь |
| 4.Изучение нового материала | В данной реакции металл растворился в воде. По способности растворять вода не имеет себе равных: 1500000 млн. тонн руд находятся на дне Тихого океана! Вся таблица Менделеева имеется в океанической воде. А знаете ли вы, что в 1 м куб. морской воды растворено до 0.01 мг золота! Общее кол-во золота в морях и океанах огромно. Если бы его удалось извлечь, то на каждого жителя нашей планеты пришлось бы более 1 тонны. А “живая вода” – раствор серебра. Благодаря бактерицидному свойству серебра она долго хранится, промытые ей раны быстро заживают. Часто понятие “раствор” мы связываем, прежде всего, с водой, с водными растворами. Есть и другие растворы: например спиртовые раствор йода, одеколона, лекарственные настойки. Хотя именно вода является самым распространённым соединением и “растворителем” в природе. ¾ поверхности Земли покрыто водой Если бы всю воду равномерно распределить по всему земному шару, то глубина “мирового океана” составила бы 4 км. Человек на 70% состоит из воды. В сутки человек выделяет 3 литра воды и столько же нужно ввести в организм. Овощи – 90% воды содержат (рекордсмены-огурцы -98%) Рыба 80% (рекордсмен у животных – медуза 98%) Хлеб – 40% Молоко – 75%2 0% мировых запасов пресной воды – озеро Байкал. Чистота воды в нем – заслуга рачка эпишура, который пропускает через себя всю воду. Вода обладает уникальными свойствами. Об одном из них вы узнаете из презентации “Послание воды”. | В кружева будто одеты
Деревья, кусты, провода,
И кажется сказкою это
А, в сущности, только вода. Безбрежная ширь океана
И тихая заводь пруда
Струя водопада и брызги фонтана
И это всё только вода.
Презентация
“Послание воды” |
| 5.Закрепление | С глубокой древности человек связан с использованием воды и водных растворов: изготовление красок, стекла, керамики. Производство глиняных изделий, выработка цветной глазури, покрывающей стены подземных гробниц фараонов, искусство бальзамирования в Древнем Египте основано на растворах. Так что же такое раствор? Признаки химического взаимодействия (схема) 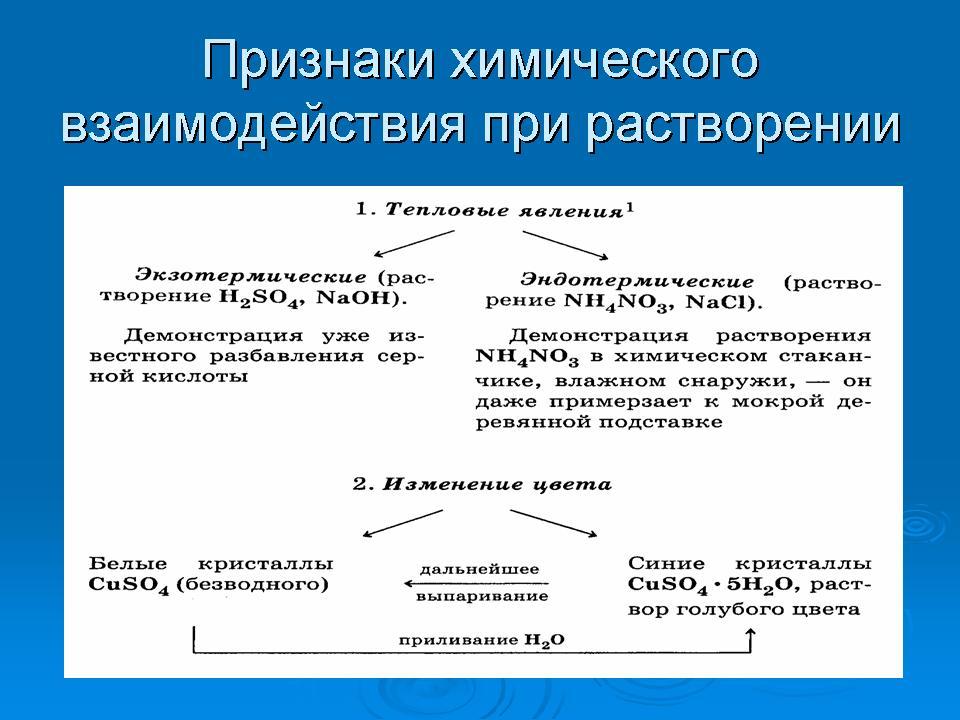
Факторы, от которых зависит растворимость (схема). 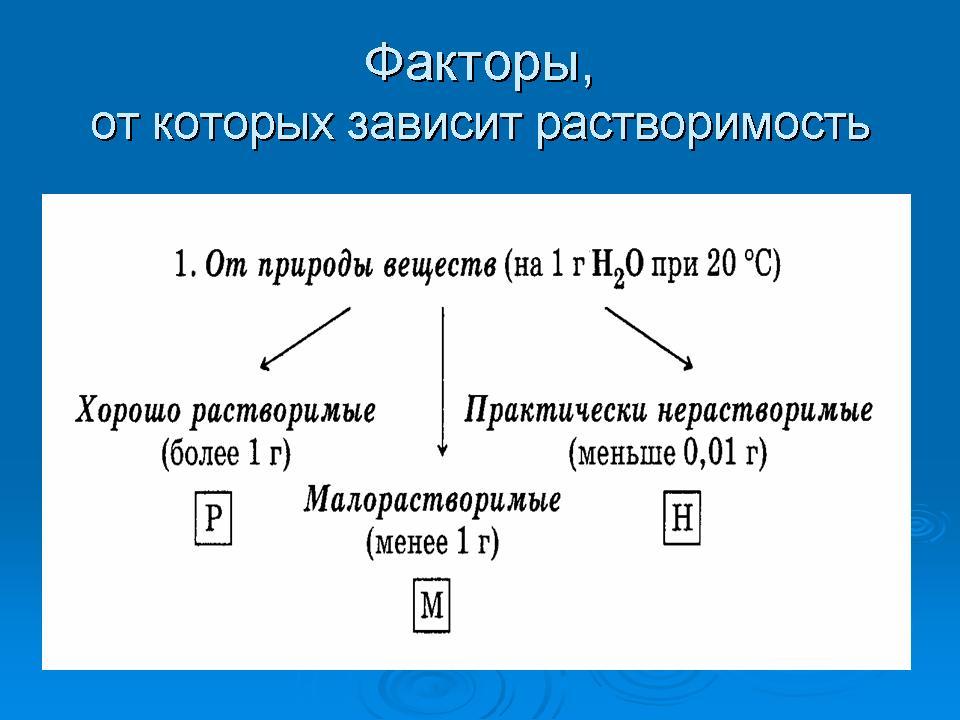 | Опорный конспект вклеивают в тетради. (Разобрать на слайде.) Обратить внимание на формулы кристаллогидратов-солей, в составе которых входит вода (кристаллизационная) Схему в тетрадь зарисовать Обложка учебника (таблица растворимости)
Схему в тетрадь зарисовать. |
| 5.Закрепление | Задание 1. Пользуясь учебником (стр.138, рис. 39), определите растворимость KCl при температуре 10/ 30/ 80ºС. Задание 2. Типы растворов по содержанию растворённого вещества. 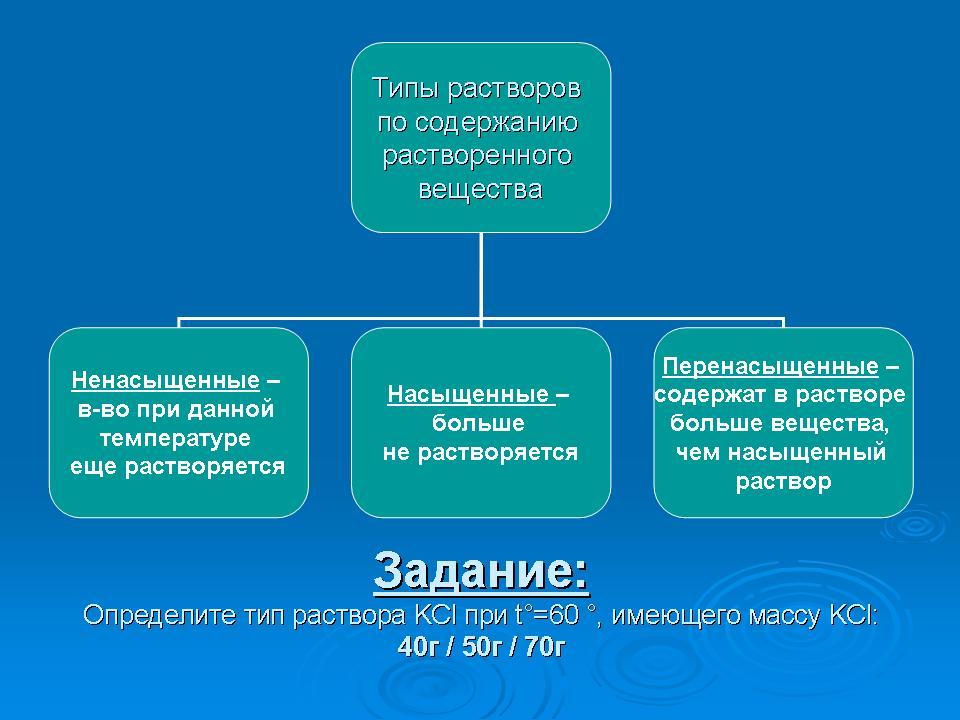 Пользуясь учебником (стр.138, рис. 39) определите тип раствора KCl при t° = 60°, имеющего массу KCl:
40г / 50г / 70г | Работа с учебником. (Ответ: 30, 40, 60 г.)
Схему в тетрадь нарисовать. (Ответ: насыщенный, ненасыщенный, перенасыщенный) |




















