Дата:
Класс: 9
Учитель:
Предмет: Химия
Тема: «Азотная кислота, её физические и химические свойства».
Контролируемые элементы содержания
Химические свойства сложных веществ: оксидов, оснований, кислот, солей
Контролируемые умения
Осознание химических превращений неорганических веществ как основы многих явлений живой и неживой природы
Объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также зависимость применения веществ от их свойств Объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также зависимость применения веществ от их свойств.
Проверяемые элементы содержания
Азотная кислота, её получение, физические и химические свойства (общие как представителя класса кислот и специфические)Взаимодействие концентрированной азотной кислоты с медью
Предметные умения
Характеризовать физические и химические свойства соединений азота (азотной кислоты, нитратов), способы их получения, применение и значение в природе и жизни человека
Раскрывать смысл основных химических понятий, иллюстрировать их взаимосвязь и применять эти понятия при описании свойств веществ и их превращений
Личностные результаты
Ориентация в деятельности на современную систему научных представлений об основных закономерностях развития человека, природы и общества, взаимосвязях человека с природной и социальной средой
Функциональная грамотность
Объяснить потенциальные применения естественнонаучного знания для общества
Вспомнить и применить соответствующие естественнонаучные знания .Анализировать, интерпретировать данные и делать соответствующие выводы
Тип урока: Изучение нового материала
Библиотека ЦОК: https://m.edsoo.ru/00adf306
БЛОЧНО-МОДУЛЬНОЕ ОПИСАНИЕ УРОКА:
Вхождение в тему урока и создание условий для осознанного восприятия нового материала
Мотивация на учебную деятельность
А начнём урок с рубрики «Знаете ли Вы, что…» . И сегодня объектом нашего внимания будет необыкновенная особа.
Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей.
Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит.
Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола). Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1. Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного купороса с селитрой. Сосуд, в котором была смесь, вскоре наполнился красно-бурым «дымом».
Монах в изумлении застыл, затем убрал огонь и увидел, как в колбу-приемник стала капать желтоватая жидкость. Она действовала на все металлы, даже на серебро и ртуть. Алхимики думали, что сидящий в жидкости рыжий дым является демоном, управляющим одной из стихий природы – водой. Поэтому желтоватую жидкость называли «крепкой водой» или «крепкой водкой». Это название сохранилось до времен М. В. Ломоносова. Вот с этой кислотой, которую во времена Петра I называли «крепкой водкой» мы и познакомимся. Как сейчас называют это вещество? (показываю в колбе раствор азотной кислоты), . Её папа Оксид азота (IY) был мужчиной злого нрава и носил прозвище Лисий хвост. Её мама была простой, спокойной женщиной, звали её Вода. Союз газа и воды привёл к появлению нашей незнакомки.
Целеполагание
Внимательно рассмотрите его и скажите, что мы узнаем на уроке?
-Скажите, о чём мы сегодня будем говорить, рассматривая данную тему?
Что вы хотели бы узнать (Что?). Понять (Что?). Научиться (Чему?). Закрепить (Что?). Зачем это надо?
Учащиеся формулируют цель урока:
- Изучить характеристику азотной кислоты.
- Какие физические и химические свойства характерны для азотной кислоты.
- Какую цель можно поставить?
Цель:
- Изучить характеристику, свойства азотной кислоты
Освоение нового материала
Осуществление учебных действий по освоению нового материала
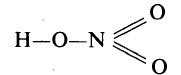
Графическая формула азотной кислоты:
Физические свойства азотной кислоты:
Агрегатное состояние - жидкость;
Цвет - отсутствует;
Запах - едкий, кислотный;
Растворимость в воде - хорошая;
"Дымит" на воздухе;
"Особые приметы":
при хранении на свету разлагается, приобретая желтоватый оттенок:
4HNO3=4NO2 + O2
+ O2 + 2H2O
+ 2H2O
В лаборатории чистую азотную кислоту получают нагреванием кристаллической натриевой или калиевой селитры (KNO3, NaNO3) с концентрированной серной кислотой:
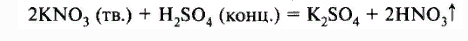
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
Характеристика азотной кислоты:
1. По основности:
2. По содержанию кислорода:
3. По растворимости в воде:
4. По стабильности:
5. По летучести:
6. По степени диссоциации:
Химические свойства
1. Свойства HNO3 как электролита.
Учащиеся вспоминают основные общие свойства кислот. Далее учитель последовательно демонстрирует: изменение окраски лакмуса и взаимодействие азотной кислоты с оксидом меди(II), гидроксидом меди(II) (предварительно получив его) и с карбонатом натрия. По ходу демонстрации учащиеся комментируют признаки химической реакции, после чего записывают уравнения проведенных реакций в молекулярном и ионном виде с последующим обсуждением результатов (слайд № 12)
Азотная кислота изменяет окраску индикатора: HNO3 = H+ + NO3 - (сильный электролит) взаимодействует:
а) с оксидами металлов:
б) с основаниями:
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
в) с солями:
2. Окислительные свойства азотной кислоты
Учитель рассказывает об особенностях взаимодействия азотной кислоты с металлами и демонстрирует взаимодействие HNO3 с медью (используется кусочки медной проволоки). Учащиеся записывают уравнения реакции. Учитель акцентирует внимание на том, что азотная кислота никогда не восстанавливается до водорода. (слайд № 13):
Взаимодействует с металлами:
K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Hg, Ag, Au
Ме + HNO3 - Me(NO3)n + H2O + NxOy
Cu + 4HNO3(конц) = Cu(NO3)2 + 2H2O + 2NO2
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 4H2O + 2NO
Me + HNO3  Me(NO3)2 + H2
Me(NO3)2 + H2
Применение азотной кислоты.
Области применения азотной кислоты:
Производство азотных удобрений;
Производство взрывчатых веществ;
Производство красящих веществ;
Лекарственные препараты;
Синтез различных химических веществ;
Полимерные материалы (пластмассы)
2.2. Проверка первичного усвоения
1. Выберите, какие из перечисленных свойств характеризуют физические свойства азотной кислоты:
Твердое агрегатное состояние;
Хорошая растворимость в воде;
Отсутствие запаха;
Желтый цвет;
Разлагается на свету с выделением азота;
"Дымит" на воздухе.
2. Назовите вещества, с которыми может реагировать азотная кислота, запишите соответствующие уравнения реакций:
SO2
H2
ZnO
Ca(OH)2
HCl
Na2SiO3
Ag
Применение изученного материала.
Применение знаний, в том числе в новых ситуациях
игра «ДА, НЕТ»
• степень окисления азота в азотной кислоте +4
• азотная кислота хорошо растворяется в воде
• разбавленная азотная кислота реагирует с золотом
• при взаимодействии концентрированной азотной с медью выделяется оксид азота 4
• азотная кислота одноосновная кислородсодержащая кислота
• азотная кислота по степени диссоциации сильная кислота
проверяем ответы по слайду
1-да
2-нет
3-да
4-нет
5-да
6-да
7-да
Выберите формулу азотной кислоты:
+ HNO3
- HNO2
- H2NO3
- H2NO5
Какие соли называют селитрами?
- сульфаты
+ нитраты
- нитриты
- хлориды
HNO3 является:
- электролитом средней силы
- неэлектролитом
- слабым электролитом
+ сильным электролитом
В
ыполнение заданий в форме ГИА (ОГЭ, ЕГЭ)
Развитие функциональной грамотности
Составь синквейн: АЗОТ
1. одно существительное _____________________________;
2. два прилагательных _______________________________
___________________________________________________;
3. три глагола ______________________________________
__________________________________________________
__________________________________________________;
4. фраза из 4 слов __________________________________
__________________________________________________
__________________________________________________;
5. одно слово – синоним или метафора ________________
_________________________________________________.
Систематизация знаний и умений
Взаимодействие с оксидами металлов. В пробирку с оксидом магния наливаем азотную кислоту. Оксид магния растворяется. Напишите уравнение реакции.
ОТВЕТ:  .
.
Верны ли следующие суждения о свойствах азота?
А. Азот бесцветный газ без вкуса и запаха.
Б. Азот легче воздуха
А) верно только А ; В) верны оба суждения;
Б) верно только Б ; Г) оба суждения неверны
Верно ли следующее утверждение: «Чистая HNO3 – дымящаяся жидкость без цвета и запаха»?
- да
+ нет
- без запаха, но очень быстро меняет цвет
- невозможно определить ни цвет, ни запах
Подведение итогов, домашнее задание
Рефлексия
1. Мне было комфортно на уроке.
2. Я много узнал нового.
3. Это мне пригодится в жизни.
4. Я приняла активное участие в обсуждении темы.
5. Мне это не интересно.
Домашнее задание.
Составить 3 уравнения реакции взаимодействия азотной кислоты с солями.







 + O2
+ O2 Me(NO3)2 + H2
Me(NO3)2 + H2










