Дата:
Класс: 8
Учитель:
Предмет: Химия
Тема: «Строение электронных оболочек атомов элементов Периодической системы Д. И. Менделеева».
Контролируемые элементы содержания
Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в Периодической системе Д.И. Менделеева и строения атома
Строение атома. Строение энергетических уровней атомов первых 20 химических элементов Периодической системы Д.И. Менделеева.
Контролируемые умения
Формирование умений устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире
Овладение понятийным аппаратом и символическим языком химии.
Проверяемые элементы содержания
Состав и строение атомов.
Строение электронных оболочек атомов первых 20 химических элементов Периодической системы Д.И. Менделеева
Предметные умения
Использовать при выполнении учебных заданий тексты учебника, справочные материалы (периодическую систему химических элементов Д. И. Менделеева, таблицу растворимости кислот, оснований и солей в воде, электрохимический ряд напряжений металлов)
Личностные результаты
Овладение языковой и читательской культурой как средством познания мира
Ориентация в деятельности на современную систему научных представлений об основных закономерностях развития человека, природы и общества, взаимосвязях человека с природной и социальной средой
Функциональная грамотность
Анализировать, интерпретировать данные и делать соответствующие выводы
Овладение языковой и читательской культурой как средством познания мира
Тип урока: Комбинированный урок
Библиотека ЦОК: https://m.edsoo.ru/00ada6bc
БЛОЧНО-МОДУЛЬНОЕ ОПИСАНИЕ УРОКА:
Вхождение в тему урока и создание условий для осознанного восприятия нового материала
Актуализация опорных знаний
Как мы узнали с Вами на прошлом уроке, атом химического элемента состоит из протонов, нейтронов и электронов.
Электрон вращается вокруг ядра, причем с огромной скоростью. За 1 сек. он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–6 лет непрерывной работы двигателя. Но пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако, форма и размер которого зависят от энергии электрона. Такие облака называют электронные облака, или орбитали.
Целеполагание
Цели урока:
сформировать представления об электронной оболочке атома и энергетических уровнях
научиться составлять электронные формулы атомов, определять элементы по их электронным формулам
рассмотреть электронное строение атомов элементов первых трёх периодов
Освоение нового материала
Осуществление учебных действий по освоению нового материала




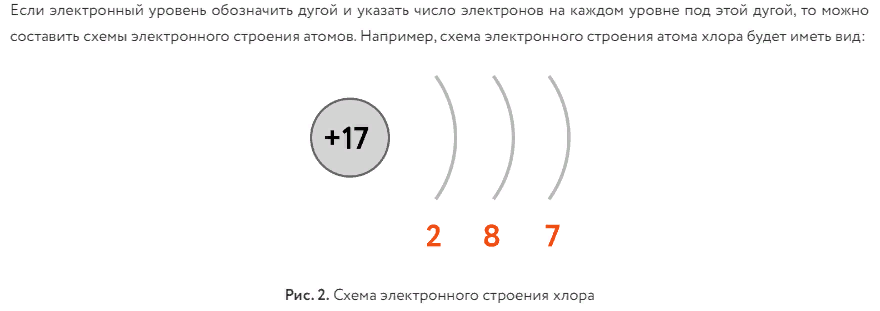
Если проанализировать электронное строение атомов, связывая его с положением химического элемента в Периодической таблице Д.И. Менделеева, то можно сделать следующие выводы:
Число электронов на внешнем энергетическом уровне у элементов главных подгрупп равно номеру группы.
Химические свойства определяются не всеми электронами, а только теми, которые обладают наибольшей энергией — так называемыми валентными. Число валентных электронов равно номеру группы. Число валентных электронов определяет принадлежность элемента к металлам или неметаллам, свойства образованных этим элементом соединений и его валентность в этих соединениях. Атомы элементов со сходными свойствами имеют сходное строение внешних электронных уровней, например: щелочные металлы содержат на внешнем уровне один электрон, углерод и кремний — четыре, галогены — семь.
С увеличением порядкового номера элемента число валентных электронов периодически повторяется, что обусловливает периодическое изменение свойств элементов и их соединений.
Графически любая орбиталь изображается в виде квантовой ячейки:

Р аспределение электронов по орбиталям называют электронной конфигурацией атома. Заполнение электронных орбиталей происходит в соответствии со следующими принципами.
аспределение электронов по орбиталям называют электронной конфигурацией атома. Заполнение электронных орбиталей происходит в соответствии со следующими принципами.
П РИНЦИП ПАУЛИ
РИНЦИП ПАУЛИ

2.2. Проверка первичного усвоения
В помощь учителю: (Перед правильными ответами знак +)
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8+
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4+
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3+
4) 4
У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
2) 3
3) 2+
4) 4
Применение изученного материала.
Применение знаний, в том числе в новых ситуациях
Составьте электронные формулы для элементов 3 периода

С
 истематизация знаний и умений
истематизация знаний и умений


Проверка приобретенных знаний, умений и навыков
4.1 Диагностика/самодиагностика
Установи соответствие между названием химического элемента и строением его атома


Подведение итогов, домашнее задание
Рефлексия
Вспомните, какие цели мы поставили перед собой в начале урока. Сделайте вывод, выполнены ли они. Представьте, что наш класс — атом. Вы являетесь элементарными частицами. Давайте посмотрим, выполнили ли мы задачи, которые поставили перед собой в начале урока. Для этого у вас на столах лежат жетоны разных цветов.
Красный жетон — протоны — это значит, что я все понял, могу объяснить другому. Зеленый — нейтроны — по данной теме у меня остались вопросы.
Желтый — электроны — недостаточно понял тему, сам ошибаюсь.
Покажите, насколько вы достигли поставленную цель?
Домашнее задание.
Составить электронные формулы атомов элементов 4 периода К и Са?












 аспределение электронов по орбиталям называют электронной конфигурацией атома. Заполнение электронных орбиталей происходит в соответствии со следующими принципами.
аспределение электронов по орбиталям называют электронной конфигурацией атома. Заполнение электронных орбиталей происходит в соответствии со следующими принципами. РИНЦИП ПАУЛИ
РИНЦИП ПАУЛИ


 истематизация знаний и умений
истематизация знаний и умений 












