Просмотр содержимого документа
«Поурочный план урока химии в 11 классе на тему "Скорость химической реакции"»
Поурочный план урока по предмету "Химия" в 11 классе
| Дата: |
|
| Тема занятия: | Скорость химических реакций. Факторы, влияющие на скорость химических реакций |
| Общие цели: | Сформировать понятие о скорости химической реакции и факторах, которые на нее влияют |
| Результаты обучения: | Учащиеся будут знать определения скорость х.р., фаза, скорость гомогенной реакции, скорость гетерогенной реакции, лимитирующая стадия; формулы для расчета скорости х.р., скорости гомогенной и гетерогенной реакции, среднюю скорость, факторы, влияющие на скорость реакции |
| Содержание урока | Деятельность учителя | Деятельность учеников |
| Организационный момент (1 мин) | Психологический настрой Притча "Три кедра" | Внимательно просматривают презентацию |
| Побуждение (5 мин) | Проблемная ситуация: демонстрация (ОКМ, НП, УВО, ТиО) | Просматривают видео опыт: Стружка цинка и соляная кислота Цинк и соляная кислота Где скорость больше? почему???? |
| Реализация (23 мин) | Стратегия "Дневник двойной записи" (ОКМ, НП, УВО, ТиО, ИКТ) | Внимательно читают материал учебника и заполняют таблицу | Фраза важная для понимания | Почему она важна??? | |
|
|
|
| Подведение итогов (4 мин) | Составьте 5 вопросов по теме урока | Составляют вопросы разного порядка, перекрестный опрос |
| Домашнее задание (2 мин) | §4.1 №6, 9; §4.2 №5, 6, 7, 8 |
Скорость химической реакции (υ) – определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени

ΔC=с2-с1 Δt=t2-t1 1 моль/л∙с 1 кмоль/м3∙мин
Раздел химии, изучающий скорость химической реакции, называется химической кинетикой
Скорость реакции определяется изменением количества вещества в единицу времени.

Стадии гетерогенной реакции
Подвод реагирующего вещества к поверхности ϑ1
Химическая реакция на поверхности ϑ2
Отвод продукта реакции от поверхности ϑ3
Определяющей стадией некоторых реакции является вторая – собственно химическая реакция.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией
Факторы, влияющие на скорость химической реакции
природа реагирующих веществ;
концентрация реагирующих веществ;
поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях);
температура;
действие катализаторов.


Математическое выражение закона действующих масс.
По закону действующих масс скорость реакции, уравнение которой А+В=С может быть вычислена по формуле:
v1= k1CACB, а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле:
v2= k2CACB.
В этих формулах: CA и CB – концентрации веществ А и В (моль/л), k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакции.
Эти формулы также называют кинетическими уравнениями.
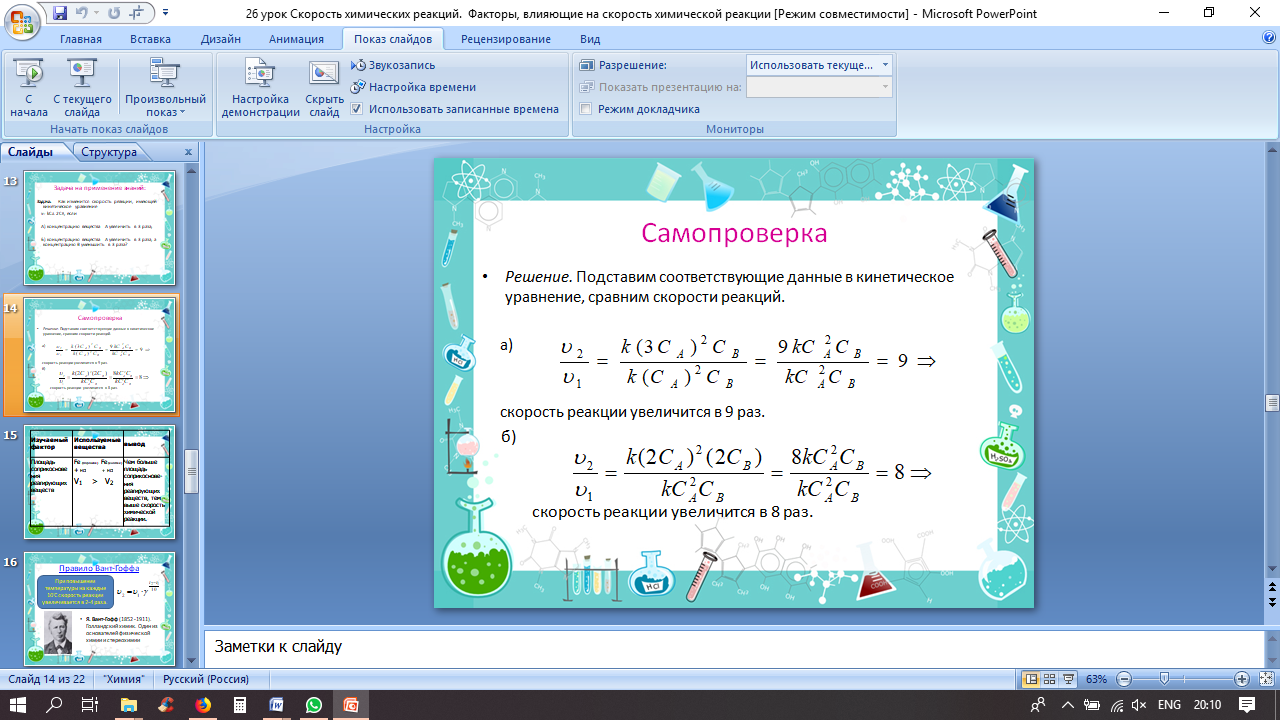
Задача. Как изменится скорость реакции, имеющей кинетическое уравнение
v= kCA2CB, если
А) концентрацию вещества А увеличить в 3 раза;
Б) концентрацию вещества А увеличить в 3 раза, а концентрацию В уменьшить в 3 раза?




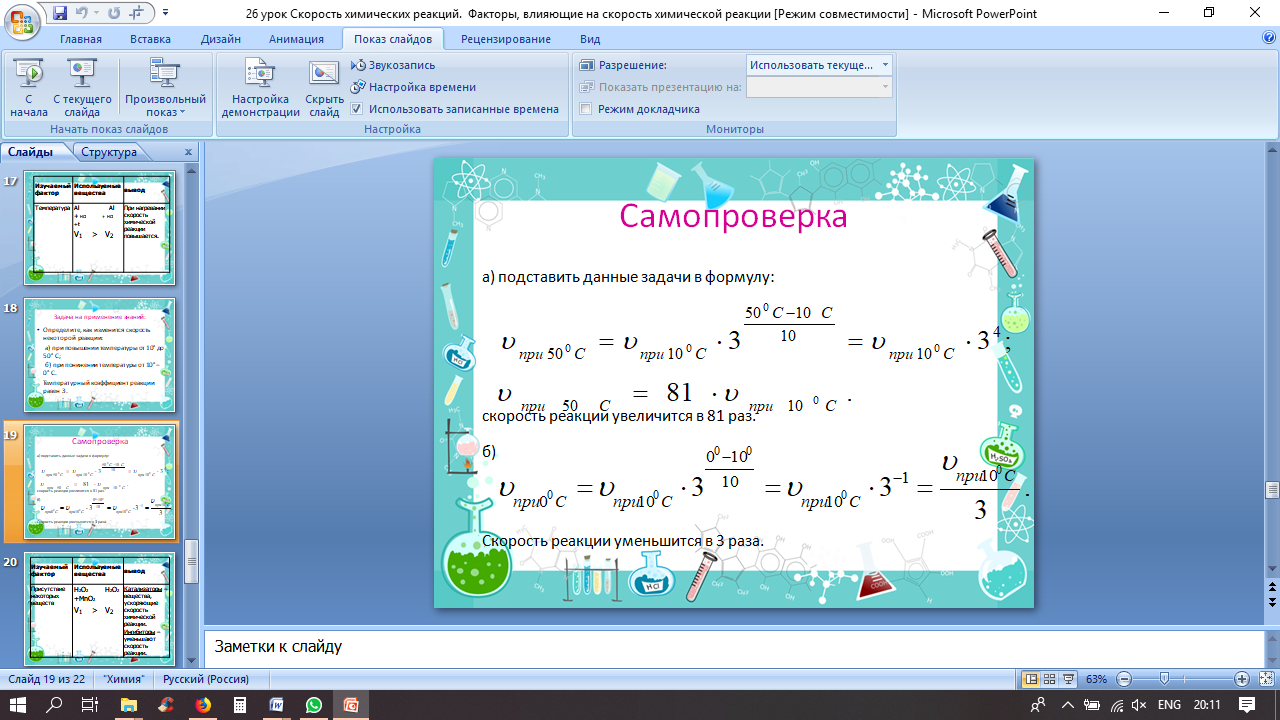
Задача: Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10° до 50° С; б) при понижении температуры от 10° – 0° С. Температурный коэффициент реакции равен 3.


Выводы по теме: «Скорость химических реакций»
Химические реакции протекают с различными скоростями. Величина скорости реакции зависит от объёма в гомогенной системе и от площади соприкосновения реагентов – в гетерогенной.
На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации Eа.
Скорость реакции зависит от факторов:
- природа реагирующих веществ;
- температура;
- концентрация реагирующих веществ;
- действие катализаторов;
- поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).



























