Практическая работа № 1. «Решение экспериментальных задач»
Цель:
- научиться описывать свойства веществ в ходе демонстрационного эксперимента, характеризовать условия прохождения реакции в растворах электролитов
- закрепить знания о свойствах кислот, оснований и солей как электролитов
- совершенствовать умения составлять уравнения реакций в молекулярном и ионном видах
Оборудование : виртуальная лаборатория
Вещества : виртуальная лаборатория
Ход работы
I. Выполнение работы
Задание 1. Осуществите эксперимент: https://www.youtube.com/watch?v=fLJVMLOp8h4
https://www.youtube.com/watch?v=lrvoKhy2IAs
В трёх пробирках дан раствор хлорида магния. В первую пробирку прилейте раствор гидроксида натрия, во вторую — карбоната натрия, в третью — нитрата цинка.
1. 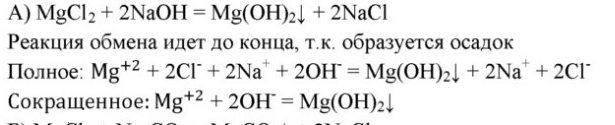
2. MgCl 2 + Na 2 CO 3 =
3. MgCl 2 +Zn(NO3)2 =
Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
Задание 2. На основании сокращенного ионного уравнения запишите полное ионное и молекулярное уравнения:
 1.Cu2+ + 2OH - = Cu(OH)2
1.Cu2+ + 2OH - = Cu(OH)2
 2. Ba2+ + SO42- = BaSO4
2. Ba2+ + SO42- = BaSO4
Задание 3.
В пробирке дан раствор соли – сульфата алюминия( Al 2 SO4 )
С помощью уравнения гидролиза этой соли, определите среду раствора и объясните свой ответ.
Задание 4.
Выберите правильный ответ
1) Кислая среда в растворе определяется наличием ионов:
а) OH-, б) NH4+; в) H+.
2) Реакции ионного обмена идут до конца, если в результате:
а) выделяется газ; б) образуется вода; в) выпадает осадок; г) все вышесказанное верно.
3) Чтобы получить осадок, достаточно слить следующие растворы:
а) Na2CO3 + HCl; б) K2SO4 + CuCl2; в) Na3PO4 + AgNO3.
III. Вывод:
1.
2.
3.
Дата______ Класс 9___
Практическая работа № 2 по теме «Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Цель: решая экспериментальные задачи, закрепить знания о свойствах кислот, оснований и солей как электролитов и условиях протекания реакций ионного обмена; совершенствовать умения составлять уравнения реакций в молекулярном и ионном видах, решать практические задачи по получению веществ, исходя из сокращённого ионного уравнения.
Оборудование и реактивы: штатив с пробирками, химические стаканы, гранулы цинка, растворы: серной кислоты, метиловый оранжевый, гидроксид натрия, карбонат кальция, хлорид железа (III).
Ход работы
I. Инструктаж по ТБ и выполнению работы.
II. Выполнение работы
II вариант.
Задание 1.
Выберите правильный ответ
1) Щелочная среда в растворе определяется наличием ионов:
а) OH; б) NH4+; в) H+.
2) Верная запись правой части уравнения электролитической диссоциации сульфата алюминия:
а) Al3+ + SO42- б) 2Al3+ + 3SO42- в) Al3+ + 4SO2-.
3) Чтобы получить газ, достаточно слить следующие растворы:
а) Na2CO3 + HCl; б) K2SO4 + CuCl2; в) Na3PO4 + AgNO3.
Задание 2. Осуществите эксперимент:
налейте в пробирку 1 мл раствора серной кислоты и опустите гранулу цинка.
Опишите наблюдения и ход работы. Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде, покажите переход электронов и объясните, что в этой реакции является окислителем.
Задание 3. Осуществите эксперимент:
Последовательно осуществите 2 реакции для серной кислоты:
Опыт 1. К 1 мл серной кислоты добавьте 1мл раствора гидроксида натрия;
Опыт 2. К 1 мл раствора серной кислоты добавьте1 мл раствора хлорида бария
Опишите наблюдения и ход работы. Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
Задание 4. Подберите соответствующие реактивы и осуществите реакции, соответствующие сокращенным ионным уравнениям:
Fe3+ + 3OH- = Fe(OH)3
Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
III. Вывод: (в выводе отметьте, каких целей вы достигли и укажите, что такое реакции ионного обмена и условия их протекания)






 1.Cu2+ + 2OH - = Cu(OH)2
1.Cu2+ + 2OH - = Cu(OH)2 









