Практическая работа
Свойства дисперсных систем
Теоретическая часть
Существует несколько правил для составления мицелл:
1. Основа мицеллы – агрегат, нерастворимый в данной дисперсионной среде, состоящий из множества (m) молекул (атомов) простого вещества (осадка).
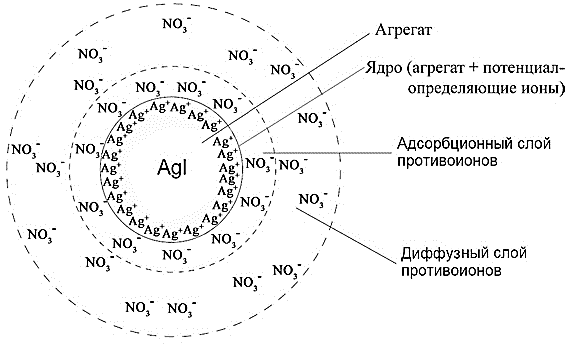
2. Согласно правилу Пескова-Фаянса-Панета, на поверхности агрегата адсорбируются ионы электролита-стабилизатора, входящие в состав агрегата, либо имеющие общую природу с ним, либо специфически взаимодействующие с ним и находящиеся в избытке. Ионы, сообщающие агрегату поверхностный заряд, называются потенциалопределяющими. Агрегат + потенциалопределяющие ионы = ядро мицеллы.
3. Заряд ядра компенсируется эквивалентным количеством противоположно заряженных ионов электролита-стабилизатора – противоионов. Часть противоионов, прочно связанных с ядром, входит в адсорбционный слой. Агрегат + адсорбционный слой = коллоидная частица (имеет заряд).
4. Остальная часть противоионов образует диффузионный слой.
5. Суммы электрических зарядов коллоидной частицы и диффузионного слоя равны друг другу по абсолютной величине и противоположны по знаку.
6. Электрический заряд коллоидной частицы равен алгебраической сумме электрических зарядов потенциалопределяющих ионов и противоионов адсорбционного слоя.
7. Мицелла гидрофобного золя является электронейтральной, т.е. алгебраическая сумма электрических зарядов ионов всех слоев равна нулю
Для любого типа реакции одно из исходных веществ берут в избытке по сравнению со стехиометрически необходимым соотношением:
Na3AsO3 + 3AgNO3 → ↓Ag3AsO3 + 3NaNO3
избыток осадок
Электролитическая диссоциация электролита, взятого в избытке:
Na3AsO3 « 3Na+ + AsO3-
Заряд коллоидной частицы определяется так (правило 6):
n(-3) + 3(n – x)(+1) = -3x
Для проверки правильности записи формулы мицеллы подсчитывают алгебраическую сумму зарядов всех ионов (правило 7):
n(-3) + 3(n – x)(+1) + 3х(+1) = 0
Коллоидная частица имеет отрицательный заряд, мицелла в целом электронейтральна.
Получение золей гидроксидов металлов. Например, золь гидроксида железа получается по реакций:
FeCl3 + 3H2O Fe(OH)3+ 3HCl
Степень гидролиза возрастает с повышением температуры и с увеличением разведения. Возможны следующие схемы строения мицелл:
{[mFe(OH)3] nFe3+(3n–x)Cl–}х+ хСl–
{[mFe(OH)3] nFeO+(n–x)Cl–}х+ хСl–
При смешивании разбавленных растворов, содержащих неодинаковые количества солей хлорида бария и сульфата натрия, образуется золь сульфата бария:
Na2SO4 + BaCl2 BaSO4+ 2NaCl
Строение мицеллы золя зависит от того, раствор какого электролита взят в избытке:
{[mBaSO4]nBa2+ (2n–x)Cl–}х+хСl– (избыток раствора BaCl2)
{[mBaSO4] nSO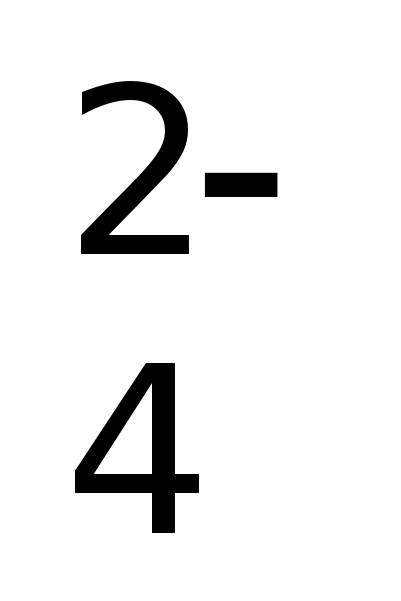 (2n–x)Na+}х– хNa+ (избыток раствора Na2SO4).
(2n–x)Na+}х– хNa+ (избыток раствора Na2SO4).

Алгоритм решения задач
Задача I. Золь хромата серебра получен путем смешивания равных объемов 0,005М раствора K2CrO4 и 0,012M раствора BaCl2. Напишите схему строения мицеллы золя и укажите знак заряда ее гранул.
Решение
Составьте уравнение реакции, лежащей в основе получения золя:
K2CrO4 + BaCl2 BaCrO4 + 2KCl
Так как С(BaCl2) C(K2CrO4), то при равных объемах растворов количество BaCl2 больше количества K2CrO4 (0,012V 0,005V). Следовательно, в избытке находится BaCl2.
Агрегат мицеллы золя образуют микрокристаллы плохо растворимого BaCrO4. По правилу Панета – Фаянса на поверхности агрегата будут адсорбироваться потенциалопределяющие ионы, родственные веществу агрегата и находящиеся в растворе в избытке. В нашем случае – это nBa2+.
Противоионами будут также находящиеся в избытке 2nCl–, которые распределяться следующим образом: (2n–x)Cl– будут находиться в адсорбционном слое, а остальные хCl– – в диффузном.
Схема строения мицеллы золя будет иметь следующий вид:
{[mBaCrO4] nBa2+ (2n–x)Cl–}х+ xCl–,
Гранула мицеллы, заключенная в фигурные скобки, имеет положительный заряд, т.е. знак заряда потенциалопределяющих ионов Ва2+.
Задача 2. Гранулы золя иодида серебра, полученного путем смешивания растворов AgNO3 и KCl, имеют отрицательный заряд. Какой из данных электролитов взят в избытке? Напишите формулу мицеллы.
Решение
Золь получен по следующему уравнению реакции:
AgNO3 + KCl AgCl + KNO3,
из которого следует, что агрегатом является малорастворимый иодид серебра AgCl.
Так как гранула имеет отрицательный заряд, то потенциалопределяющими ионами, по правилу Панета – Фаянса, будут отрицательные ионы, входящие в состав агрегата, т.е. Cl––ионы. Следовательно, в избытке взят раствор KCl, содержащий эти ионы.
Формула мицеллы будет иметь следующий вид:
{[mAgCl] nCl– (n–x)K+}х– xK+.
Задание 1.
Составьте схему строения мицеллы и укажите какие ионы являются
потенциалообразующими
противоионами адсорбционного слоя
противоионами диффузного слоя.
Pb2+; K+; K+
K+; NO3- ; NO3-
Pb2+; NO3- ; NO3-
K+; CrO42-; CrO22-
Задание 2.Какими свойствами иона определяется его коагулирующая сила?
знаком заряда иона
величиной заряда иона
размером иона
всеми перечисленными свойствами
Задание 3.Какие из перечисленных свойств коллоидных систем проявляются так же и в истинных растворах?
рассеяние света
явление диализа
наличие осмотического давления
коагуляции под действием электролита
электрофорез
способность проходить через бумажный фильтр правильными ответами являются:
1,2,6 2) 3 и 6 3) 1,2,3,5,6 4) 1-6
Задание 4.Молоко, сырая нефть, являются представителями дисперсных систем типа:
твёрдое в жидком
газообразное в жидком
жидкое в жидком
газообразное в газообразном
Задание 5.Молекулы ПАВ — это органические соединения, состоящие из:
из двух лиофобных частей
из двух лиофильных частей
гидрофобной и гидрофильной частей
нет правильного варианта
Задание 6.Каковы размеры частиц коллоидного раствора?
100 нм
1- 100 нм
1-1000 нм
меньше 100 нм.
Задание 7.Основные признаки дисперсных систем:
гетерогенность;
высокая раздробленность;
высокая раздробленность и гетерогенность;
гомогенность.
Задание 8. Алгоритм составления мицеллы.



















